Содержание
- 2. где A,B,M,N – химические символы реагирующих веществ, α, β, γ, δ - стехиометрические коэффициенты, показывающие число
- 3. и найти стехиометрические коэффициенты α, β, γ, δ из уравнений баланса атомов С, Н и О
- 4. Химические реакции горения и газификации протекают с выделением или поглощением тепла, которое называется теплотой реакции. Всякая
- 5. Если энергия, выделяющаяся при образовании новых связей, больше энергии, затрачиваемой на разрушение связей в исходных молекулах,
- 6. Лекция 5 Согласно 1-му началу термодинамики, изменение внутренней энергии dU или энтальпии dH = d(U+pV) реагентов
- 7. Лекция 6 Если реакция протекает при постоянном объёме (V,Т = const , изохорно-изотермический процесс), и при
- 8. Лекция 5 Теплота реакций при р,Т = const или при V,T = const не зависит от
- 9. Лекция 5 Теплота реакции равна сумме теплот сгорания исходных реагентов за вычетом суммы теплот сгорания продуктов
- 10. Компоненты горючей смеси могут находиться в одном агрегатном состоянии, например, – газообразном при сжигании газов в
- 11. Энтальпия образования сложного вещества есть энтальпия реакции его синтеза из простых в-в, взятых в наиболее устойчивых
- 12. Энтальпия сгорания простого и сложного вещества есть энтальпия реакции его полного окисления кислородом до образования высших
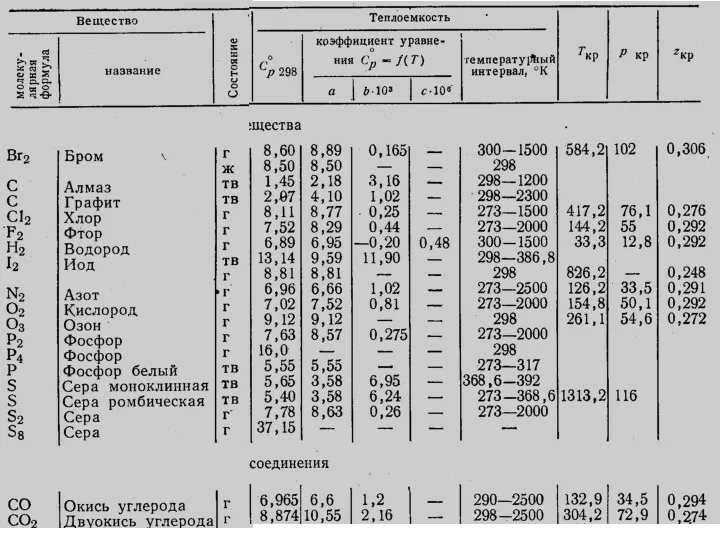
- 13. Лекция 6 ккал / моль
- 14. Лекция 5
- 15. Лекция 6
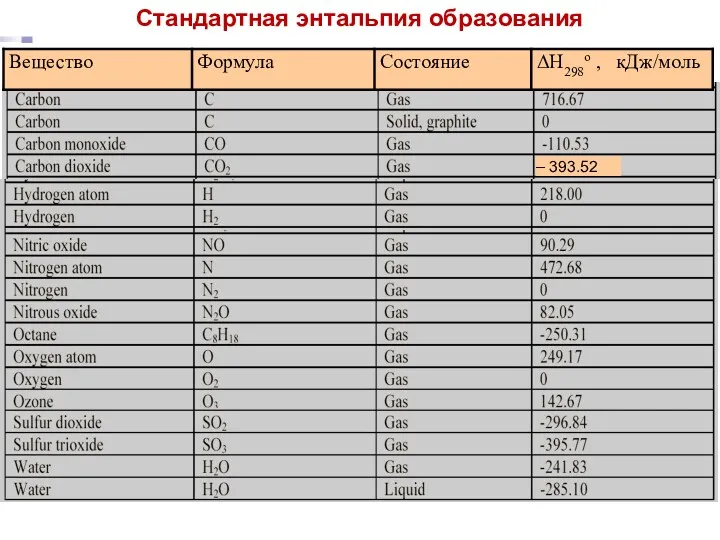
- 16. Лекция 5 – 393.52 Стандартная энтальпия образования
- 17. (11.28 = 3 × (0.79/0.21). Лекция 5 Предполгается, что смесь находится в стехиометрическом соотношении при стандартных
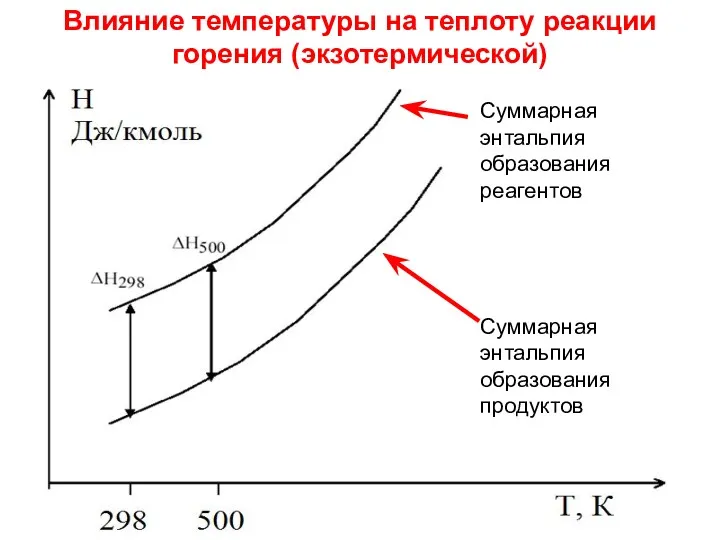
- 18. Лекция 6 Суммарная энтальпия образования продуктов Суммарная энтальпия образования реагентов Влияние температуры на теплоту реакции горения
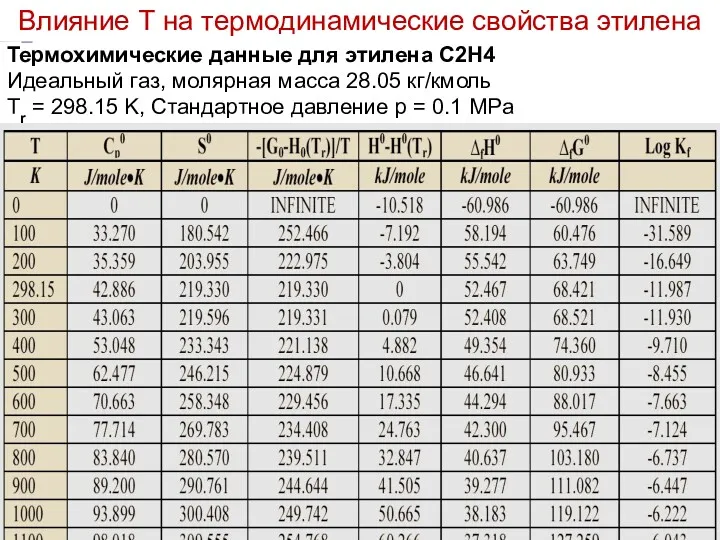
- 19. Лекция 6 Термохимические данные для этилена C2H4 Идеальный газ, молярная масса 28.05 кг/кмоль Tr = 298.15
- 20. Лекция 5 Предполгается, что смесь находится в стехиометрическом соотношении при р = 1 атм, Т =
- 21. Экспериментально установлено, что химические реакции не всегда протекают до полного превращения исходных веществ. Наряду с продуктами
- 22. Скорость химической реакции, как будет показано далее, пропорциональна концентрациям (количество вещества в единице объёма) участвующих в
- 23. В зависимости от условий (Т, р) равновесие может быть, например, сильно смещено в сторону продуктов реакции.
- 24. Скорость протекания химических реакций и положение равновесия зависят от химической природы реагирующих веществ, концентрации реагирующих веществ,
- 25. Лекция 6 Скорость прямой реакции в любой момент времени: а скорость обратной реакции Закон действующих масс
- 26. Здесь CA ,CB ,CM ,CN – текущие концентрации реагирующих веществ, моль/м3, k1 и k2 – коэффициенты
- 27. Результирующая скорость реакции, равная разности скоростей прямой и обратной реакций, в ходе превращения уменьшается и становится
- 28. Лекция 6 КС – безразмерная величина, называемая константой равновесия (по концентрациям). Отсюда следует выражение для концентраций
- 29. Так как k1 и k2 при данной температуре являются постоянными, то и константа равновесия КС является
- 30. Лекция 6 поэтому константу равновесия Кp можно выразить через парциальные давления газов в смеси. Для эквимолярной
- 31. Если в газовой смеси может происходить несколько различных реакций, то закон действующих масс применяется к каждой
- 32. Скорости обратных реакций разложения (диссоциации) продуктов сгорания при топочных температурах (1600-18000С и ниже) весьма малы (например,
- 33. Строго говоря, область применения закона действующих масс ограничивается идеальными газами, однако с достаточной для практики точностью,
- 34. Для процессов горения важное значение имеют гетерогенные реакции в системах, в частности, состоящих из твердого топлива
- 35. Если на систему в состоянии равновесия воздействовать извне, изменяя термодинамические параметры состояния (р, V, Т), то
- 36. Например, если прямая реакция экзотермична (протекает с выделение теплоты), как в случае реакций горения (следовательно, обратная
- 37. Лекция 6 Если из системы выводится какой-либо продукт, то равновесие сдвигается в сторону увеличения его концентрации.
- 38. Давление воздействует на положение равновесия в том случае, если реакция протекает с изменением объема газов и
- 39. Принцип Ле Шателье-Брауна указывает только направление смещения равновесия, но не дает возможности провести количественные расчеты. Соотношения,
- 40. При очень высоких температурах реакции горения вообще не протекают. Следовательно, за счет горения нельзя достичь очень
- 41. Зависимость химического равновесия реакций горения от температуры При внешнем изменении температуры равновесие системы смещается в ту
- 42. Знак "–" в правой части показывает, что: если Q = ΔrH если Q = ΔrH >
- 43. Лекция 5 G0, H0, S0– стандартные значения (р=1 атм, Т = 298 К) энергии Гиббса, энтальпии
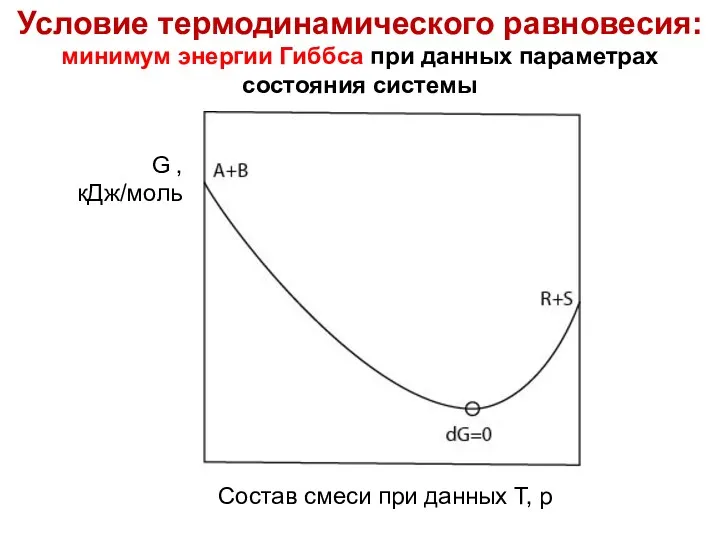
- 44. Лекция 6 Условие термодинамического равновесия: минимум энергии Гиббса при данных параметрах состояния системы
- 45. Лекция 5 Сжигание топлива при высоких температурах (Т > 1300 К) сопровождается окислением азота воздуха с
- 47. Скачать презентацию







































 Гидролиз. Необратимый гидролиз
Гидролиз. Необратимый гидролиз Растворимость. Равновесие системы осадок-раствор
Растворимость. Равновесие системы осадок-раствор Побочная подгруппа. 8 группы
Побочная подгруппа. 8 группы Галогены. Строение атома
Галогены. Строение атома Химическое кафе Кислоты
Химическое кафе Кислоты Гетерофазный катализ. (Лекция 20)
Гетерофазный катализ. (Лекция 20) Классификация кристаллов по типу химической связи
Классификация кристаллов по типу химической связи Обмен липидов
Обмен липидов Определите положение в ПСХЭ элементов
Определите положение в ПСХЭ элементов La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons
La notion de catabolisme et d’anabolisme. La bioenergetique. La chaine mitochondriale de transfert d’electrons Подготовка к ВПР по химии. 8 класс
Подготовка к ВПР по химии. 8 класс Свойства кислорода. Получение кислорода методом вытеснения воздуха
Свойства кислорода. Получение кислорода методом вытеснения воздуха Типы химических реакций
Типы химических реакций Понятия про синтетические лекарственные средства
Понятия про синтетические лекарственные средства Побочная подгруппа VIII группы периодической системы
Побочная подгруппа VIII группы периодической системы Введение. Предмет и содержание фармацевтической химии, её связи с другими науками
Введение. Предмет и содержание фармацевтической химии, её связи с другими науками Физические и химические свойства воды
Физические и химические свойства воды Physiology lab
Physiology lab Фосфорлы тыңайытқыштар
Фосфорлы тыңайытқыштар становление органической химии
становление органической химии Обмен нуклеопротеинов
Обмен нуклеопротеинов Химические свойства алканов
Химические свойства алканов ВОДОРОД
ВОДОРОД Хінони
Хінони Физические свойства минералов
Физические свойства минералов Основные понятия и законы химии
Основные понятия и законы химии Кислоты, основания, соли в свете ТЭД
Кислоты, основания, соли в свете ТЭД Роль хімії у суспільстві
Роль хімії у суспільстві