Содержание
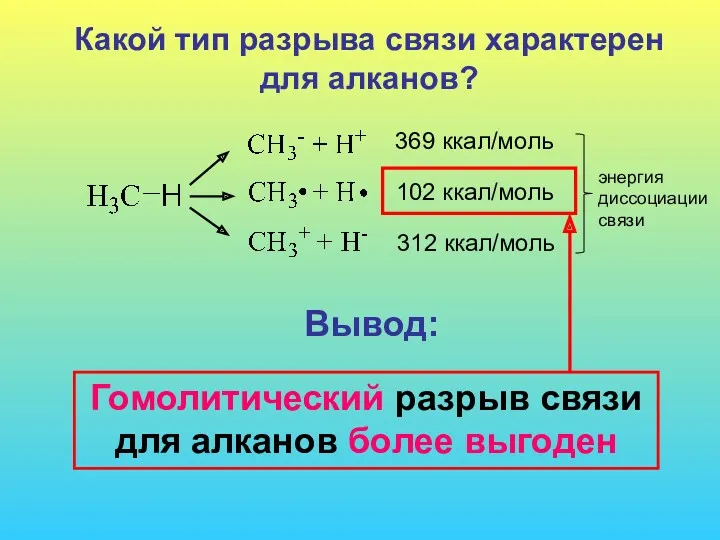
- 2. Какой тип разрыва связи характерен для алканов? 369 ккал/моль 102 ккал/моль 312 ккал/моль энергия диссоциации связи
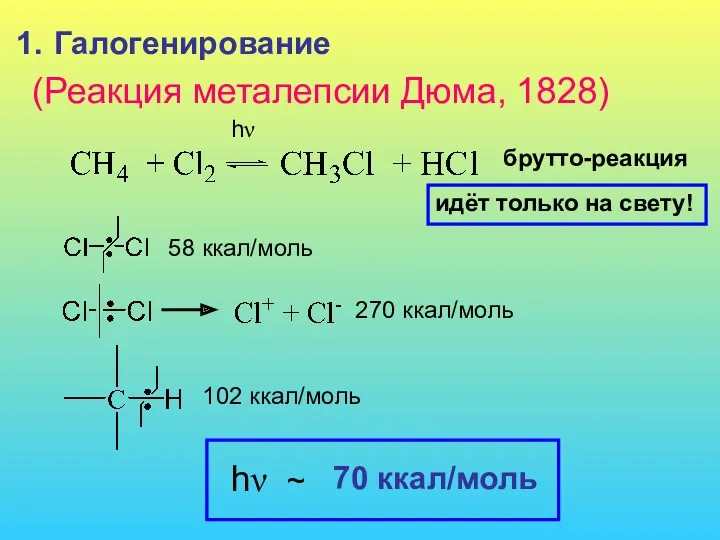
- 3. Галогенирование (Реакция металепсии Дюма, 1828) hν брутто-реакция идёт только на свету! hν 58 ккал/моль 270 ккал/моль
- 4. 1 квант света, близкого к hν, вызывает гомолиз молекулы Сl2 Реакция хлорирования протекает как цепная радикальная
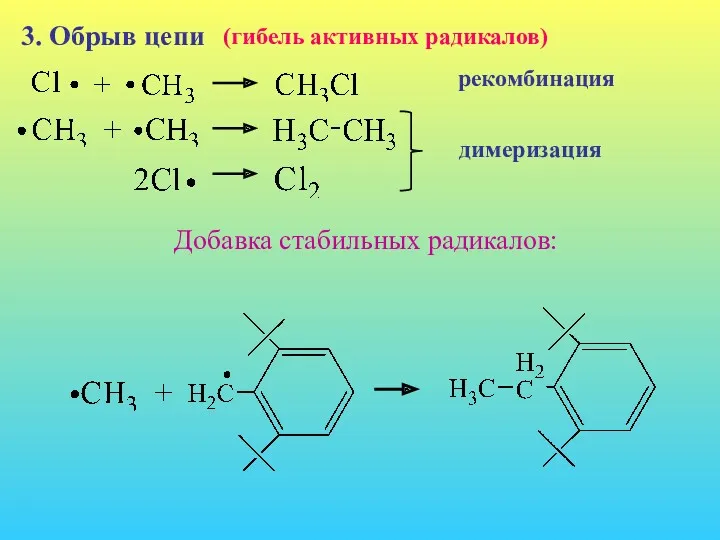
- 5. 3. Обрыв цепи (гибель активных радикалов) рекомбинация димеризация Добавка стабильных радикалов:
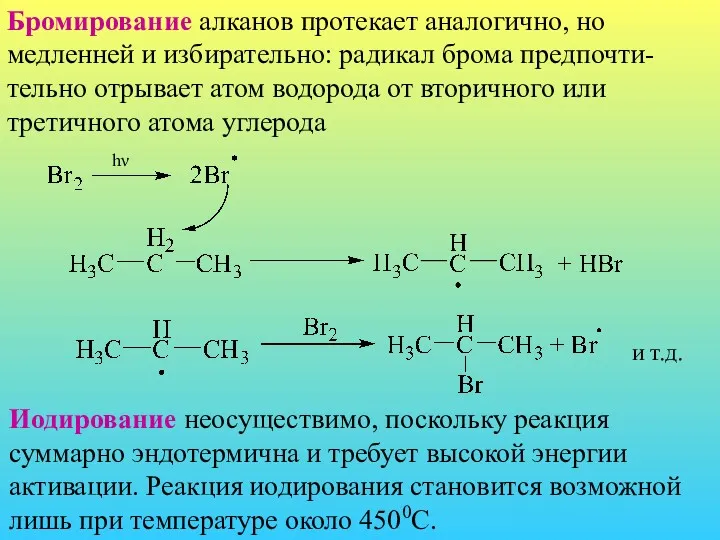
- 6. Бромирование алканов протекает аналогично, но медленней и избирательно: радикал брома предпочти-тельно отрывает атом водорода от вторичного
- 7. Фторирование – крайне экзотермичный процесс, происходит значительное обугливание. Если берется алкан отличный от метана, то в
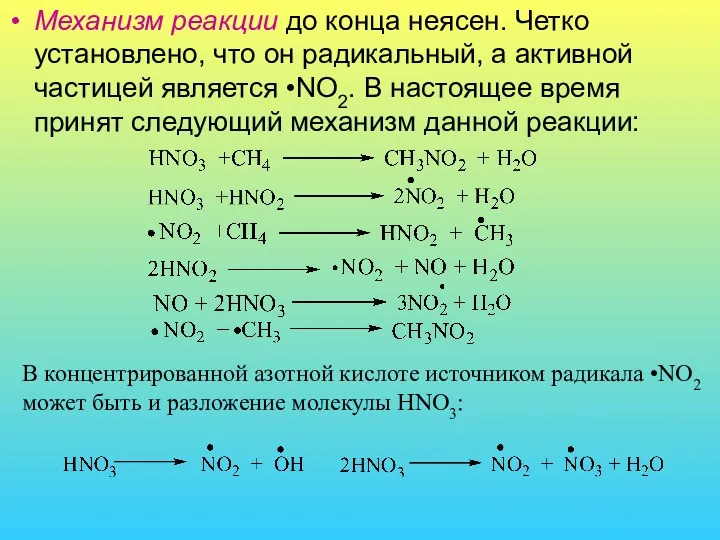
- 8. Механизм реакции до конца неясен. Четко установлено, что он радикальный, а активной частицей является •NO2. В
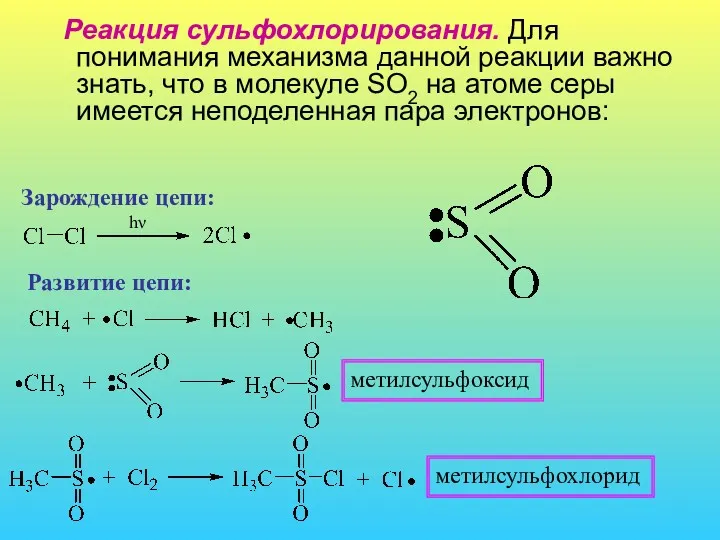
- 9. Реакция сульфохлорирования. Для понимания механизма данной реакции важно знать, что в молекуле SO2 на атоме серы
- 10. Мерзоляты – синтетические моющие вещеста Преимущественное взаимодействие алкильного радикала с диоксидом серы, приводящее к сульфохлорированию, а
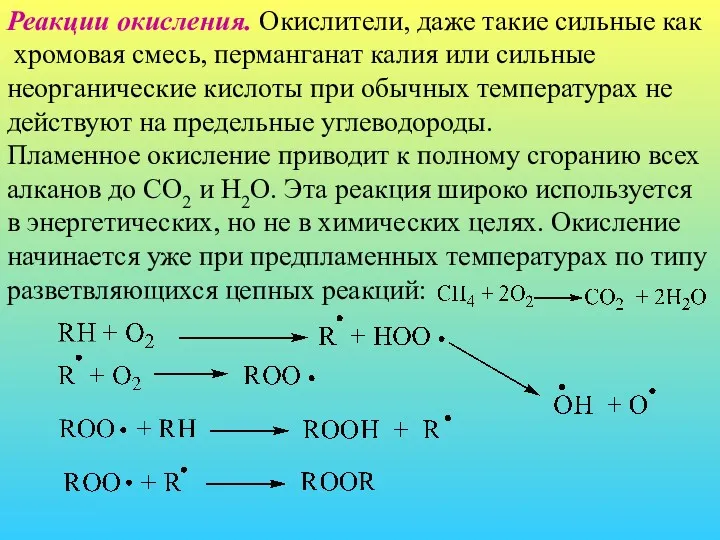
- 11. Реакции окисления. Окислители, даже такие сильные как хромовая смесь, перманганат калия или сильные неорганические кислоты при
- 12. В первой фазе окисления углеводорода RH в качестве малоустойчивых промежуточных продуктов образуются гидроперекиси ROOH, распадающиеся с
- 13. В 1927 году после того, как было обнаружено, что разные бензины обладают различными детонационными свойствами, были
- 14. Механизм действия тетраэтилсвинца в н-алканах Δ и т.д.
- 15. Несмеянов предложил ЦПМ – более эффективен и бензины с этой присадкой неядовиты: В дизельных и ракетных
- 16. Крекинг алканов. Метан – наиболее термически устойчивый из алканов. Он подвергается термическому распаду при 1400°: Это
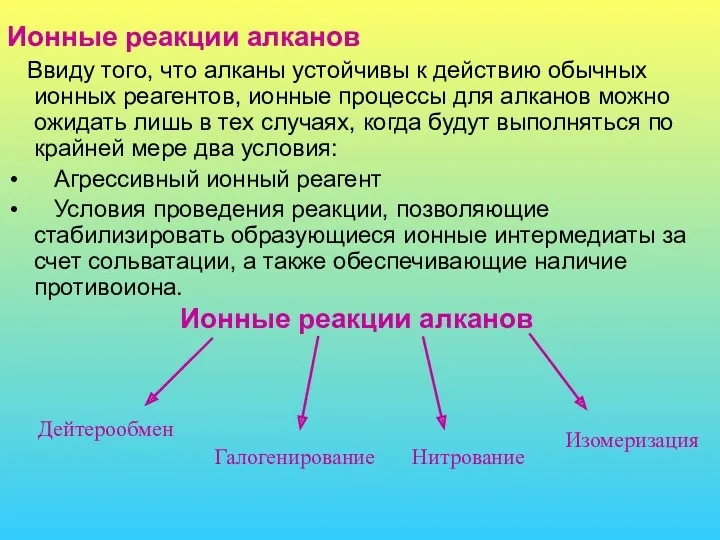
- 17. Ионные реакции алканов Ввиду того, что алканы устойчивы к действию обычных ионных реагентов, ионные процессы для
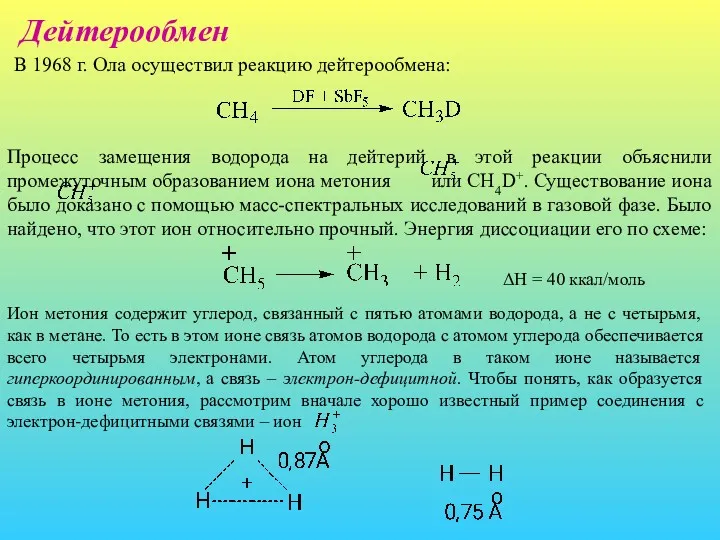
- 18. Дейтерообмен В 1968 г. Ола осуществил реакцию дейтерообмена: Процесс замещения водорода на дейтерий в этой реакции
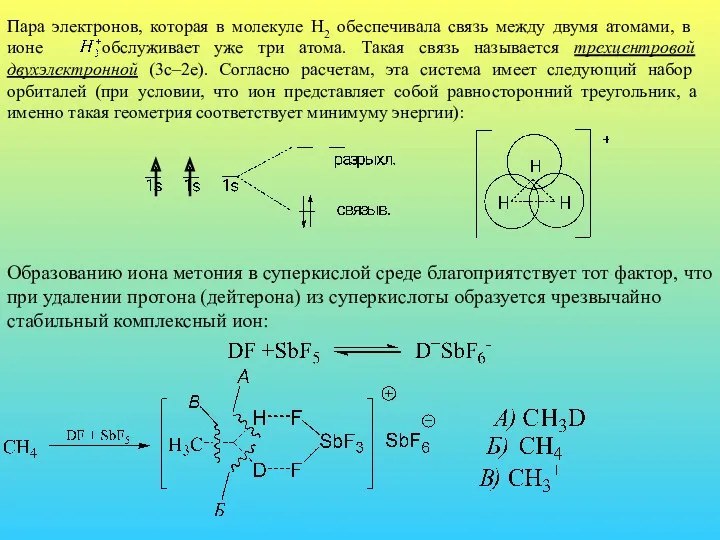
- 19. Пара электронов, которая в молекуле Н2 обеспечивала связь между двумя атомами, в ионе обслуживает уже три
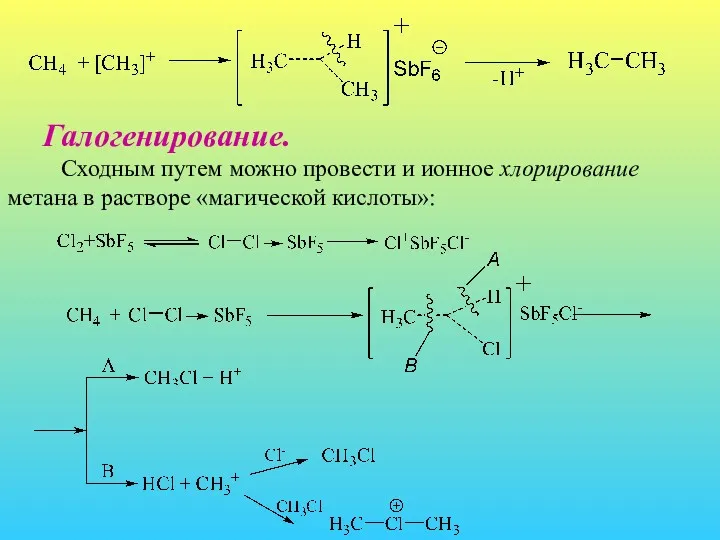
- 20. Галогенирование. Сходным путем можно провести и ионное хлорирование метана в растворе «магической кислоты»:
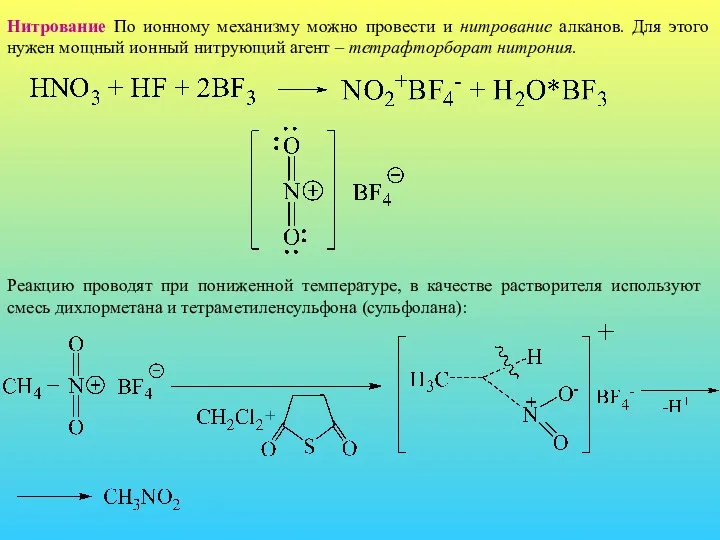
- 21. Нитрование По ионному механизму можно провести и нитрование алканов. Для этого нужен мощный ионный нитрующий агент
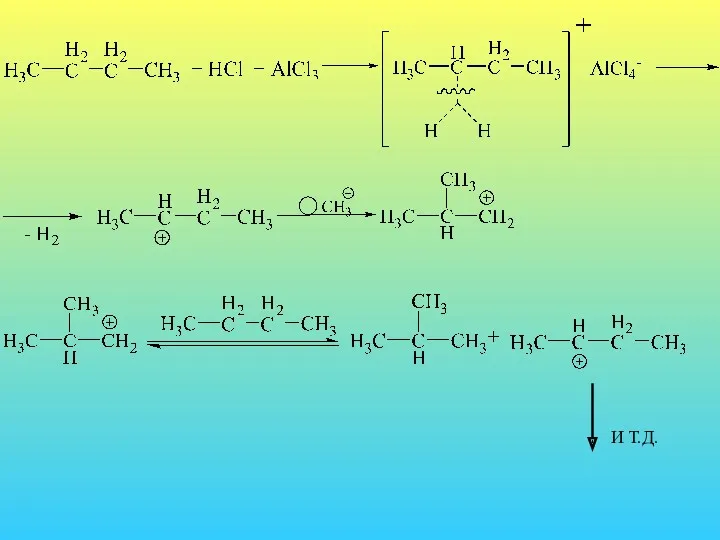
- 22. Изомеризация. В 1946 году было показано, что бутан изомеризуется в термодинамически более стабильный изобутан в присутствии
- 23. И Т.Д.
- 24. Алкилирование Электрофильное алкилирование осуществляется при взаимодействии алканов с заранее полученными карбкатионами R3C+ (например t-Bu+SbF6-) или R3C+,
- 25. Способы получения алканов Карбид алюминия 1. Из карбида алюминия можно получить метан: 2. Синтез Фишера-Тропша Из
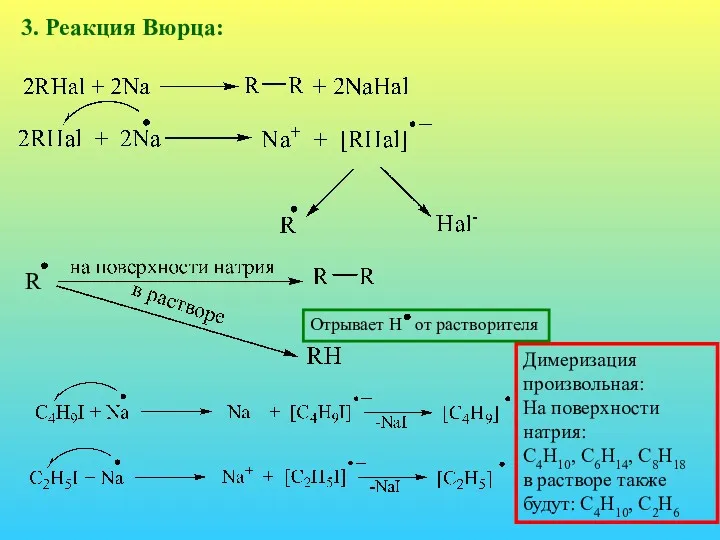
- 26. 3. Реакция Вюрца: Димеризация произвольная: На поверхности натрия: С4Н10, С6Н14, С8Н18 в растворе также будут: С4Н10,
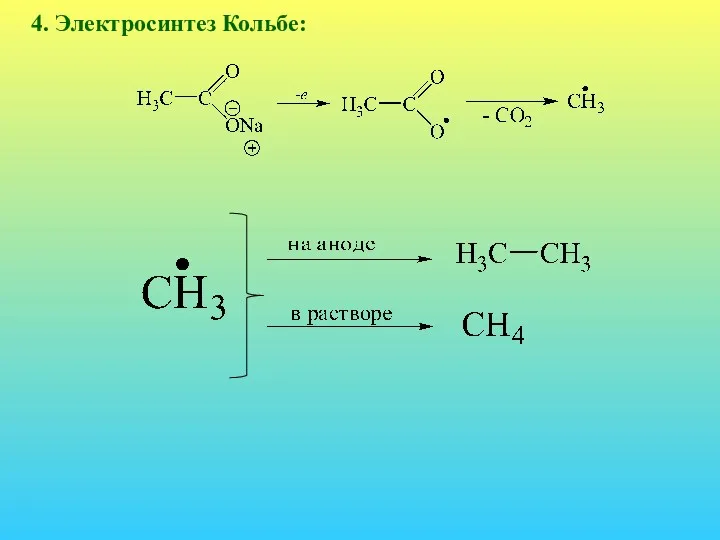
- 27. 4. Электросинтез Кольбе:
- 28. АЛКЕНЫ
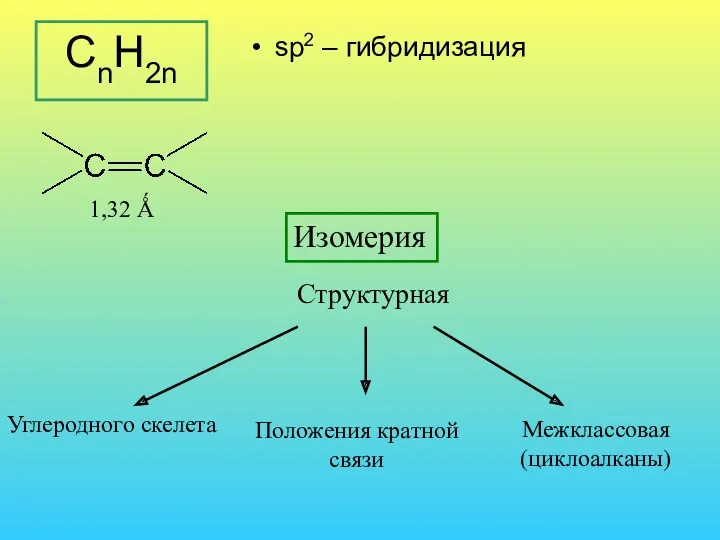
- 29. CnH2n sp2 – гибридизация 1,32 Ǻ Изомерия Углеродного скелета Положения кратной связи Межклассовая (циклоалканы) Структурная
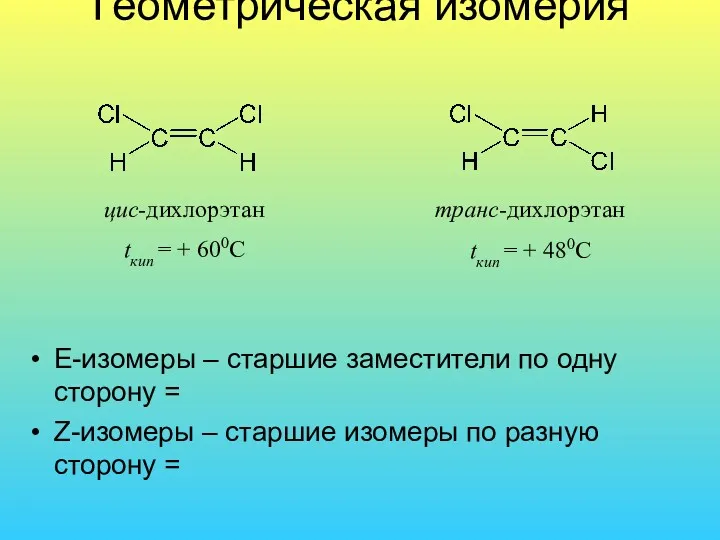
- 30. Геометрическая изомерия Е-изомеры – старшие заместители по одну сторону = Z-изомеры – старшие изомеры по разную
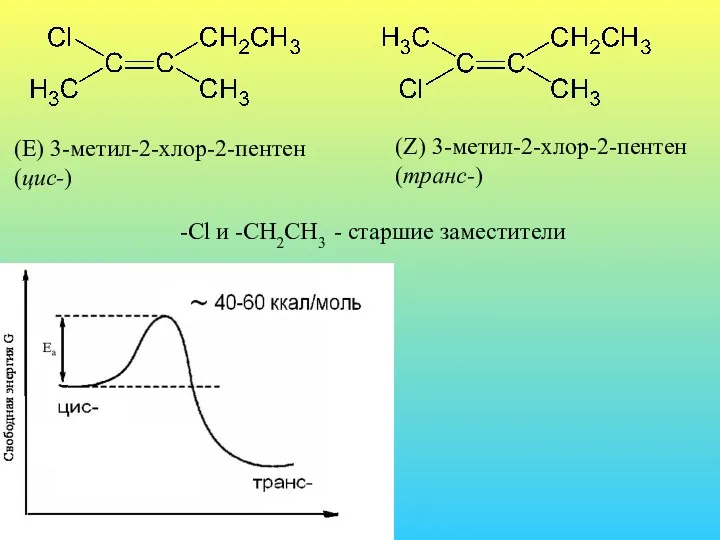
- 31. (E) 3-метил-2-хлор-2-пентен (цис-) (Z) 3-метил-2-хлор-2-пентен (транс-) -Cl и -CH2CH3 - старшие заместители
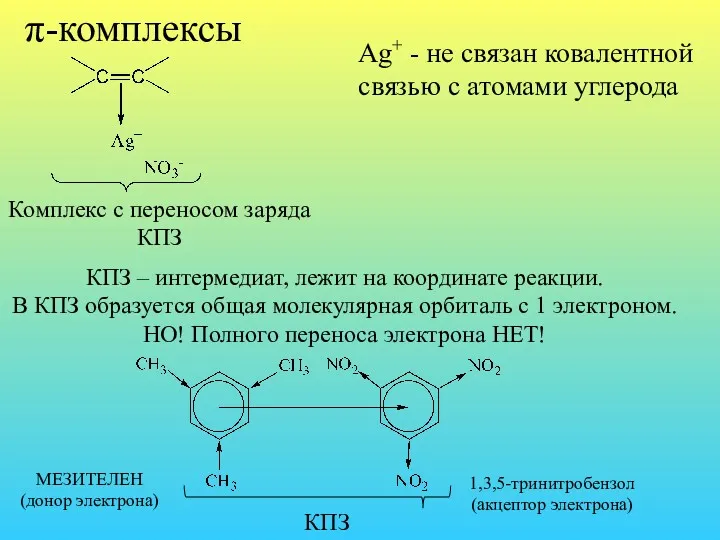
- 32. π-комплексы Комплекс с переносом заряда КПЗ Ag+ - не связан ковалентной связью с атомами углерода КПЗ
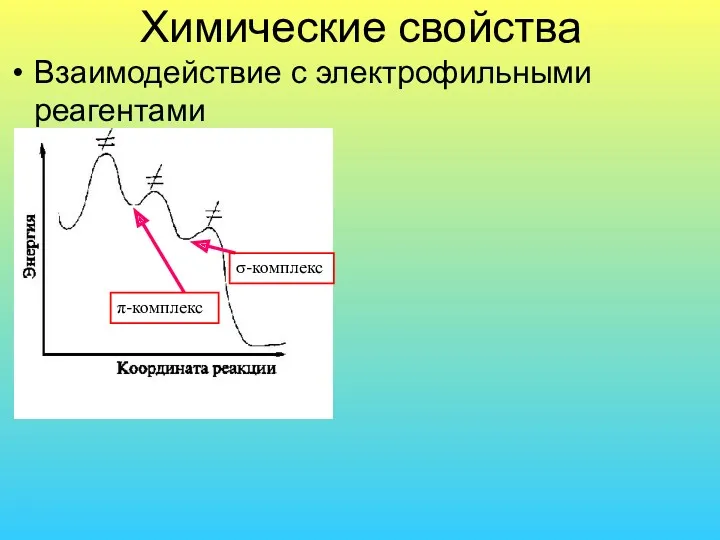
- 33. Химические свойства Взаимодействие с электрофильными реагентами π-комплекс σ-комплекс
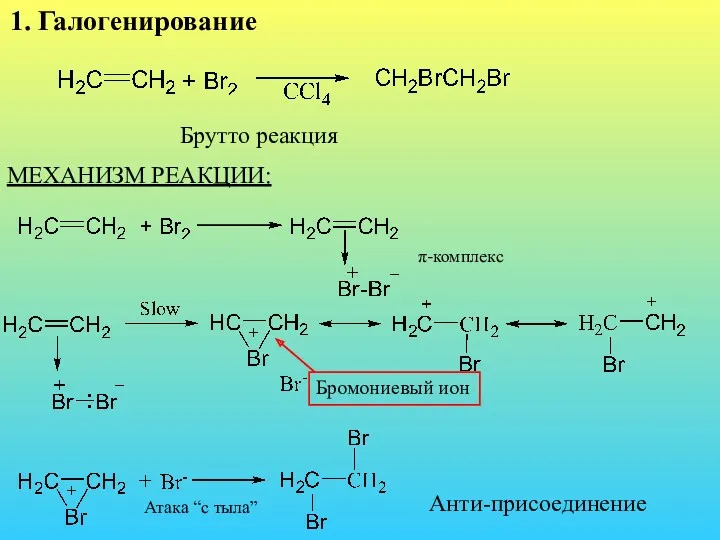
- 34. 1. Галогенирование Брутто реакция МЕХАНИЗМ РЕАКЦИИ: π-комплекс Бромониевый ион Атака “с тыла” Анти-присоединение
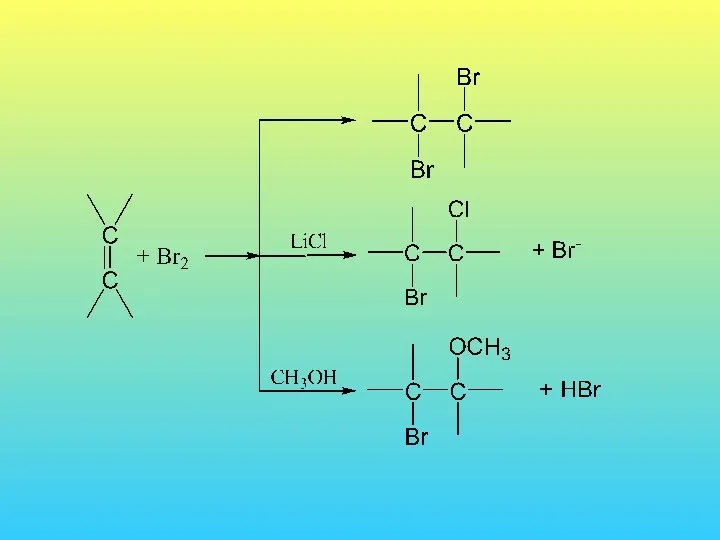
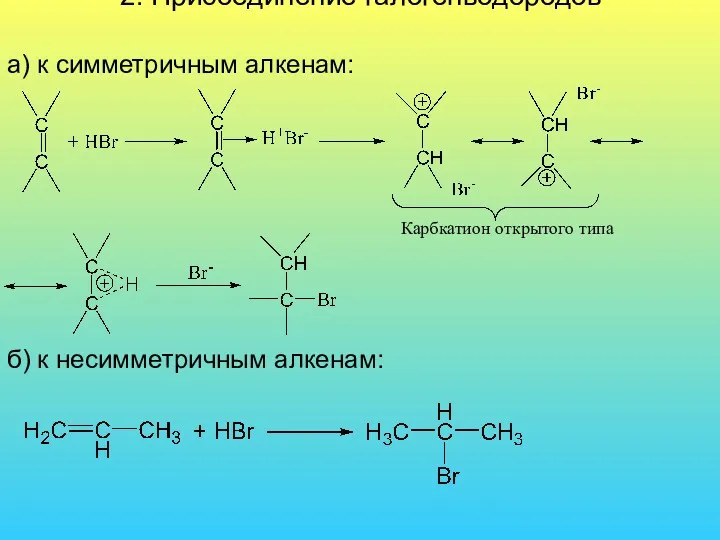
- 36. 2. Присоединение галогенводородов а) к симметричным алкенам: б) к несимметричным алкенам: Карбкатион открытого типа
- 38. Скачать презентацию












 Тайна великого открытия периодической таблицы
Тайна великого открытия периодической таблицы Химическое производство
Химическое производство Ароматические кислоты и их соли
Ароматические кислоты и их соли Перегонка с водяным паром
Перегонка с водяным паром Химический элемент йод
Химический элемент йод Введение в органическую химию
Введение в органическую химию Растворы электролитов
Растворы электролитов Использование горюче-смазочных материалов в автотранспорте
Использование горюче-смазочных материалов в автотранспорте Контрольная работа. Разбор. 9 класс
Контрольная работа. Разбор. 9 класс Титриметрический анализ
Титриметрический анализ Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Азотсодержащие органические соединения. Амины
Азотсодержащие органические соединения. Амины Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды)
Важнейшие органические вещества пищевых продуктов. Жиры.(Липиды) Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей
Вычисление массы растворённого вещества, содержащегося в определённой массе раствора с известной массовой долей Производства аммиака. Лекция 7
Производства аммиака. Лекция 7 Особенности органических веществ. Классификация органических соединений. 9 класс
Особенности органических веществ. Классификация органических соединений. 9 класс Благородные газы
Благородные газы Р-элементы IV А группы. Углерод и кремний
Р-элементы IV А группы. Углерод и кремний Классы неорганических соединений
Классы неорганических соединений Урок-аукцион Фосфор и его свойства.
Урок-аукцион Фосфор и его свойства. Решение задач. Органическая химия
Решение задач. Органическая химия NaCl или поваренная соль (плюсы и минусы)
NaCl или поваренная соль (плюсы и минусы) Менделеевские уроки. День науки
Менделеевские уроки. День науки Ферроқорытпа. Кремний және Хром
Ферроқорытпа. Кремний және Хром IV группа (побочная подгруппа)
IV группа (побочная подгруппа) Адсорбция
Адсорбция Качественные реакции
Качественные реакции Неравновесные явления в сложных химических процессах. Часть 1: электрохимия
Неравновесные явления в сложных химических процессах. Часть 1: электрохимия