Слайд 2

К/Р
Cu2S + O2 -> Cu2O + SO2
Cu2S + O2 -> CuO
+ SO2
Cu2S + O2 -> CuO + S
Слайд 3

К/Р
H2SO4 (конц) + Cu -> CuSO4 + SO2 + H2
Слайд 4

К/Р
H2SO4 (конц) + C -> H2O + CO2 + SO2
Слайд 5
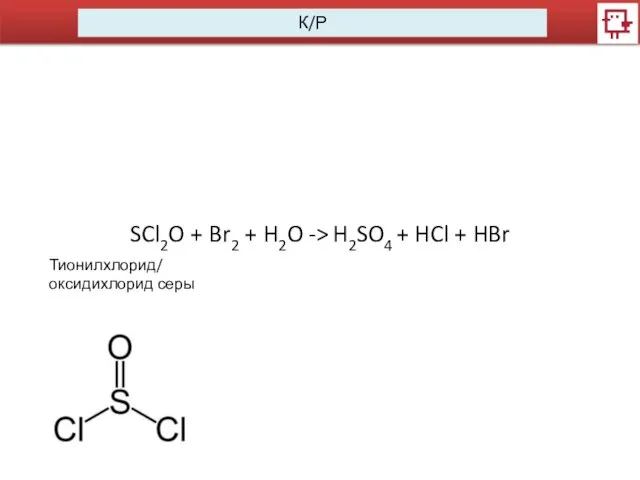
К/Р
SCl2O + Br2 + H2O -> H2SO4 + HCl + HBr
Тионилхлорид/
оксидихлорид серы
Слайд 6
К/Р
KBr + KBrO3 (конц) + HCl-> Br2 + KCl + H2O
Слайд 7

К/Р
KBr + KMnO4 + H2SO4 -> Br2 + MnSO4 + H2O
+ K2SO4
Слайд 8

К/Р
Ce(SO4)2 + H2O2 -> Ce(SO4)3 + O2 + H2SO4
Слайд 9

К/Р
KMnO4 + KHSO3 -> K2SO4 + KHSO4 + MnO2 + H2O
Слайд 10

6я группа элементов
28.11.2016
3е занятие 2го триместра
Слайд 11

Распространенность
6я группа главная подгруппа содержит элементы:
О
S
Se
Te
На долю кислорода приходится около 50%
массы земной коры и 90% массы мирового океана.
Сера встречается в природных условиях в виде залежей самородной серы и входит в состав сульфидных руд. Земная кора содержит около 0,03%; морская вода 0.1%
Слайд 12

Химические свойства кислорода
О – второй по электроотрицательности элемент.
С большинством металлов О
реагирует при комнатной температуре, образую основные оксиды.
2Mg + O2 = 2MgO
2Cu + O2 = 2CuO
C неметаллами (за исключением инертных газов) О реагирует при нагревании.
Р + О2 (60оС) -> Р2О5
S + O2 (250оС) -> SO2
C + O2 (700оС) -> CO2
Реагирует со сложными веществами:
2H2S + O2 -> 2S + 2H2O
2H2S + O2 -> 2SО2 + 2H2O
Слайд 13
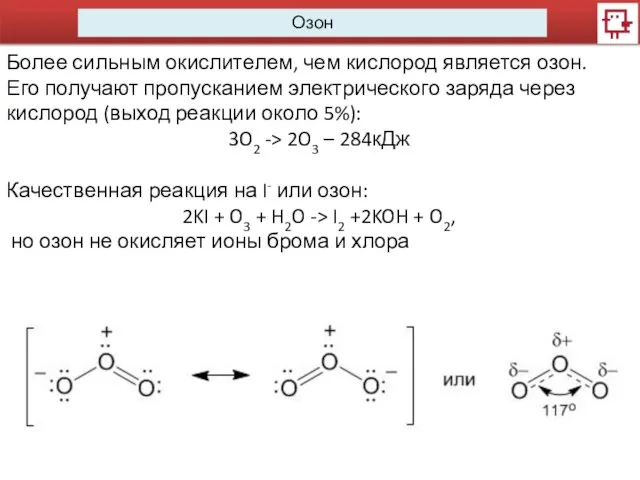
Озон
Более сильным окислителем, чем кислород является озон.
Его получают пропусканием электрического
заряда через кислород (выход реакции около 5%):
3O2 -> 2O3 – 284кДж
Качественная реакция на I- или озон:
2KI + O3 + H2O -> I2 +2KOH + O2,
но озон не окисляет ионы брома и хлора
Слайд 14

Получение
В промышленности получают:
Фракционной перегонкой жидкого воздуха (разность температур конденсации)
Электролизом воды
В лаборатории:
2KMnO4
-> K2MnO4 + MnO2 + O2
4K2Cr2O7 -> 4K2CrO4 + 2Cr2O3 + 3O2
2H2O ->2H2O + O2 (самый простой способ)
Слайд 15

Сера
При комнатной температуре сера реагирует со фтором, хлором и концентрированными кислотами-окислителями
(HNO3, H2SO4):
S + 3F2 -> SF6
S + Cl2 = SCl2
S + 6HNO3 (конц) = H2SO4 + 6 NO2 + 2H2O
S + 2H2SO4 (конц) = 3SO2 + 2H2O
Также при комнатной температуре протекает реакция со ртутью:
Hg + S = HgS
При нагревании:
2P + 3S -> P2S3
H2 + S <-> H2S + 20.6 кДж
Fe + S -> FeS
C щелочами:
2S + 6KOH -> K2SO4 + 2K2S + 3H2O
Слайд 16

Сероводород
Сероводород – бесцветный и очень токсичный газ с запахом тухлых яиц.
Получение в лаборатории:
FeS + 2HCl -> FeCl2 + H2S
Al2S3 + 6H2O -> 2Al(OH)3 + 3H2S
H2S – типичный восстановитель:
H2S + Br2 -> S + 2HBr
А так же, слабая кислота
Pb(OH)2 + H2S -> PbS + 2H2O
Слайд 17

Сернистый газ. Сернистая кислота
SO2 + H2O <-> H2SO3
Сернистый газ можно получить
при взаимодействии:
Me + 2H2SO4 (конц) -> CuSO4 + SO2 + 2H2O
H2S + O2 -> SO2 + H2O
Характерные реакции:
Реакции, протекающие без изменения степени окисления:
Ca(OH)2 + SO2 -> CaSO3 + H2O
Реакции с повышением степени окисления до +6
Na2SO3 + Cl2 + H2O -> Na2SO4 + 2HCl
Реакции протекающие с понижением степени окисления
2H2S + H2SO3 -> 3S + 3H2O
Реакции самооксиления-самовосстановления
NaSO3 + S -> Na2S2O3
















 Фенолы
Фенолы Алюминий и бор
Алюминий и бор Одноатомные спирты
Одноатомные спирты Спирты
Спирты Пластмаси та їх роль у сучасному виробництві
Пластмаси та їх роль у сучасному виробництві Аргентум, или серебро
Аргентум, или серебро Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Каменный уголь. Фенол
Каменный уголь. Фенол Органическая химия. Олигосахариды. Полисахариды
Органическая химия. Олигосахариды. Полисахариды 10 самых смертельно опасных камней и минералов
10 самых смертельно опасных камней и минералов Термодинамика химического равновесия
Термодинамика химического равновесия Зерттеу әдістері
Зерттеу әдістері Кремний и его соединения. Аллотропные модификации
Кремний и его соединения. Аллотропные модификации Химические понятия
Химические понятия Спирти
Спирти Необратимые электродные процессы. Часть 2
Необратимые электродные процессы. Часть 2 Химические свойства кислот как электролитов
Химические свойства кислот как электролитов Предмет органической химии. Органические вещества
Предмет органической химии. Органические вещества Алмаз. Алмаз дегеніміз не
Алмаз. Алмаз дегеніміз не Простые вещества - неметаллы
Простые вещества - неметаллы Обмен простых белков. Дезаминирование и трансаминирование аминокислот
Обмен простых белков. Дезаминирование и трансаминирование аминокислот Растворы. Массовая доля растворённого вещества
Растворы. Массовая доля растворённого вещества Валентность химических элементов. 8 класс
Валентность химических элементов. 8 класс В мире химии. Периодический закон и ПСХЭ
В мире химии. Периодический закон и ПСХЭ Закон Авогадро. Молярный объём газов
Закон Авогадро. Молярный объём газов Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций Физико-химические свойства алкенов
Физико-химические свойства алкенов Химическая промышленность. Минеральные удобрения
Химическая промышленность. Минеральные удобрения