Содержание
- 2. Цель: изучить состав, строение, свойства фенола и его соединений Задачи: на примере фенола конкретизировать знания учащихся
- 3. Д/З Учить параграф 5.3 Ознакомится с дополнительными источниками информации. Выполнить задание 4,5,7 на странице 154. Учебник:
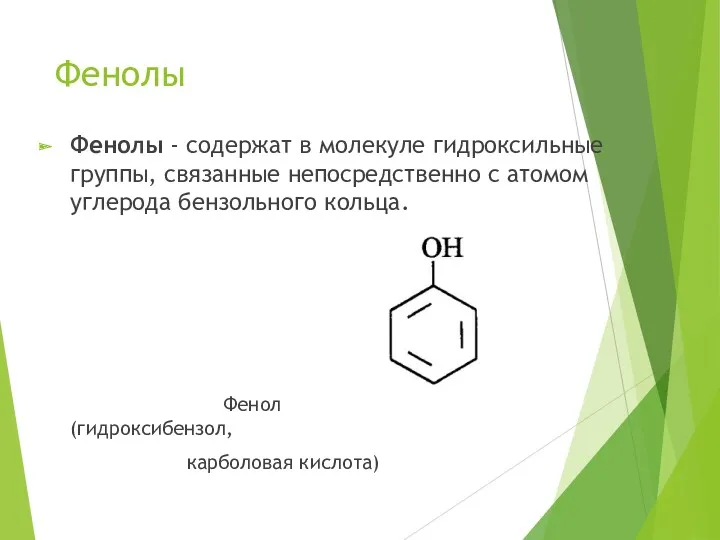
- 4. Фенолы Фенолы - содержат в молекуле гидроксильные группы, связанные непосредственно с атомом углерода бензольного кольца. Фенол
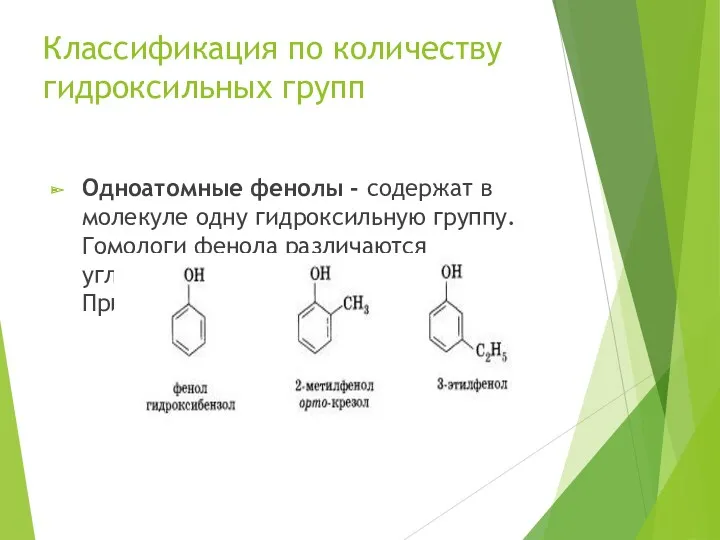
- 5. Классификация по количеству гидроксильных групп Одноатомные фенолы - содержат в молекуле одну гидроксильную группу. Гомологи фенола
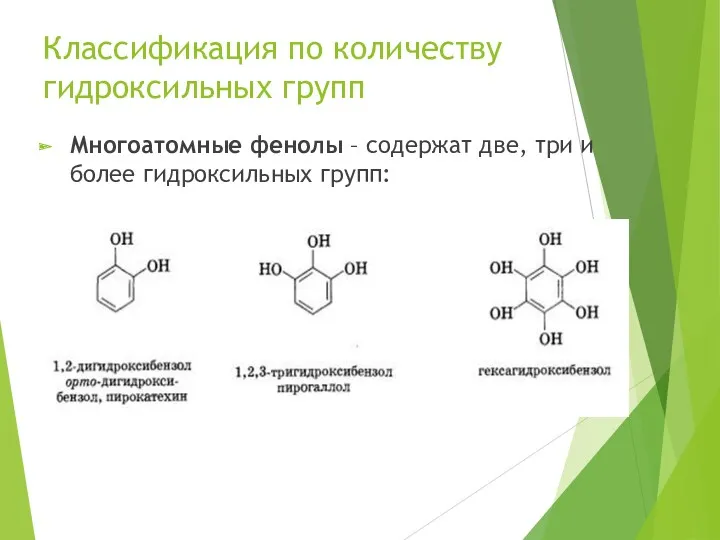
- 6. Классификация по количеству гидроксильных групп Многоатомные фенолы – содержат две, три и более гидроксильных групп:
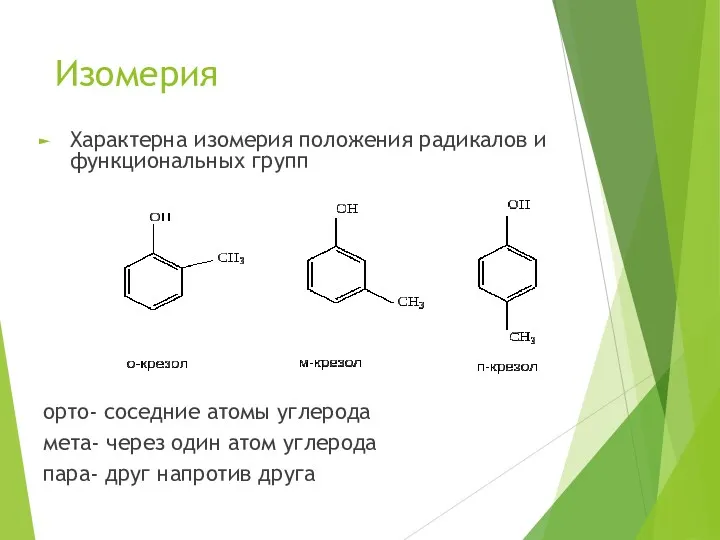
- 7. Изомерия Характерна изомерия положения радикалов и функциональных групп орто- соседние атомы углерода мета- через один атом
- 8. Номенклатура Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях фенолов используются правила номенклатуры ароматических
- 9. Фенол Фенол (С6Н5ОН -гидроксибензол, карболовая кислота) - простейший представитель класса фенолов. Фенол (карболовая кислота) был первым
- 10. Физические свойства фенола Фенол в обычных условиях - бесцветные игольчатые кристаллы, розовеющие на воздухе. Ядовит. При
- 11. Применение фенола По объёму производства фенол занимает 17-е место среди органических веществ. Используется в органическом синтезе:
- 12. Среди антисептических средств, широко применяемых в современной медицине, фенол занимает значимое место. Его растворы оказывают хорошее
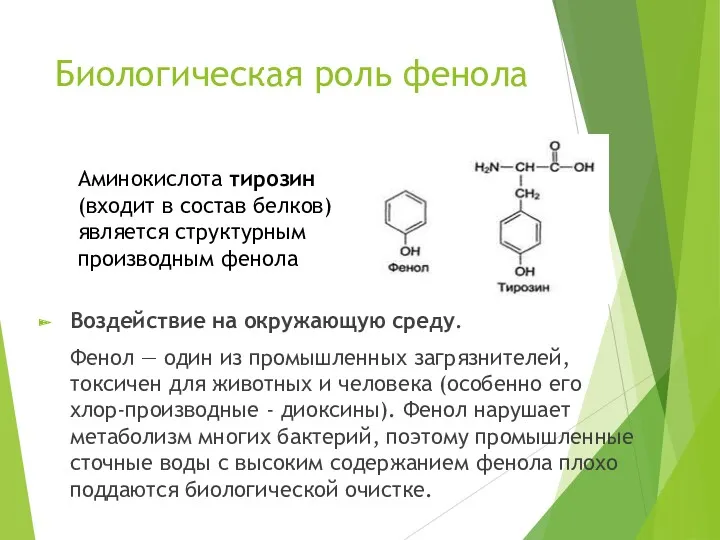
- 13. Биологическая роль фенола Воздействие на окружающую среду. Фенол — один из промышленных загрязнителей, токсичен для животных
- 14. Токсичные свойства фенола и его производных Фенол и многие его производные вызывают нарушение функций нервной системы.
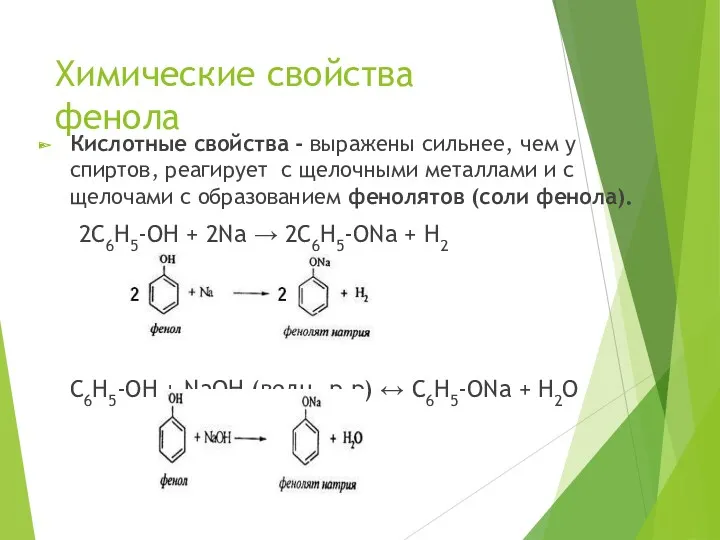
- 15. Химические свойства фенола Кислотные свойства - выражены сильнее, чем у спиртов, реагирует с щелочными металлами и
- 16. Химические свойства Однако кислотные свойства у фенолов выражены слабее, чем у неорганических и карбоновых кислот (примерно
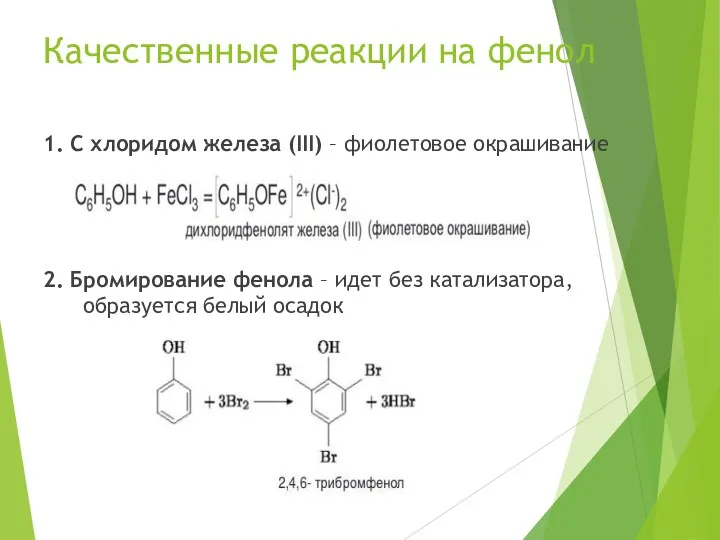
- 17. Качественные реакции на фенол 1. С хлоридом железа (III) – фиолетовое окрашивание 2. Бромирование фенола –
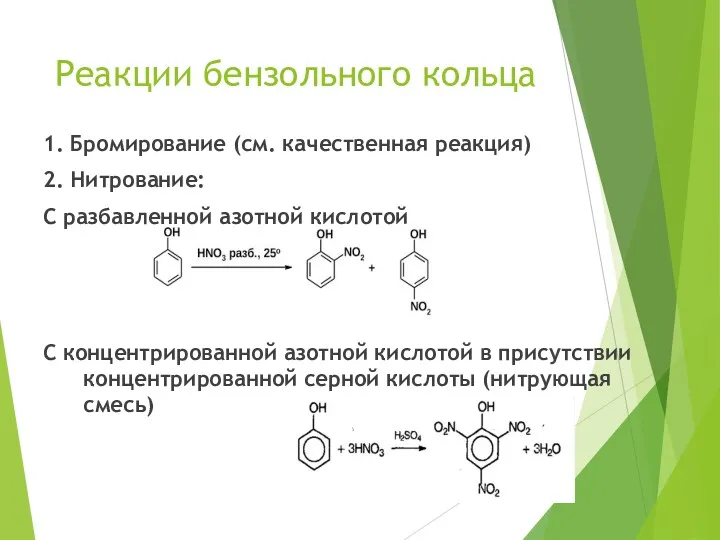
- 18. Реакции бензольного кольца 1. Бромирование (см. качественная реакция) 2. Нитрование: С разбавленной азотной кислотой С концентрированной
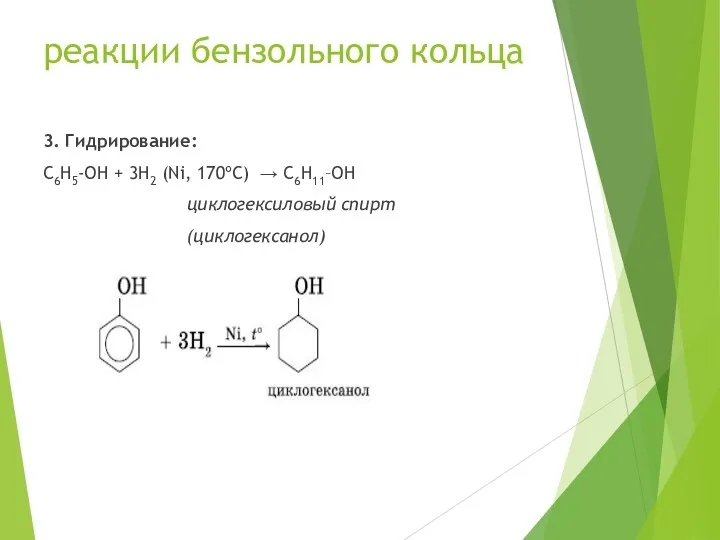
- 19. реакции бензольного кольца 3. Гидрирование: C6H5-OH + 3H2 (Ni, 170ºC) → C6H11–OH циклогексиловый спирт (циклогексанол)
- 20. Реакции бензольного кольца Окисление фенолов - легко окисляются даже под действием кислорода воздуха. Более сильные окислители
- 21. Поликонденсация фенола с альдегидами Поликонденсация фенола с альдегидами – получение фенолформальдегидных смол и твердых полимеров. Возможно
- 22. Получение фенолов Природным сырьем для получения фенолов является каменноугольная смола (содержит более 1000 различных ароматических соединений).
- 23. Вопросы 1. Фенолы – определение, классификация, изомерия. 2. Физические свойства фенола. 3. Биологическая роль и токсические
- 24. Использованные источники Учебник: Химия для профессий и специальностей естественно-научного профиля./под ред. О.С. Габриеляна. М.; «Академия», 2012.
- 26. Скачать презентацию














 Диены (диолефины, алкадиены)
Диены (диолефины, алкадиены) Застосування неметалів
Застосування неметалів Строение вещества. Химические элементы
Строение вещества. Химические элементы Простые вещества. Сложные вещества
Простые вещества. Сложные вещества Степень окисления элементов
Степень окисления элементов Химические основы жизни
Химические основы жизни Химическая связь и ее типы. Кристаллические решётки
Химическая связь и ее типы. Кристаллические решётки Периодический закон Менделеева
Периодический закон Менделеева Железо, его характеристики, свойства и соединения
Железо, его характеристики, свойства и соединения Строение атома. Периодическая таблица Менделеева. Химическая связь
Строение атома. Периодическая таблица Менделеева. Химическая связь Химический состав водоотталкивающих средств
Химический состав водоотталкивающих средств Нефть - природный источник углеводородов
Нефть - природный источник углеводородов Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C
Фазовые диаграммы бинарных систем с полиморфными превращениями на примере фазовой диаграммы системы железо-цементит Fe Fe3C Фазовое равновесие
Фазовое равновесие Энергия ионов в мембране и водных растворах
Энергия ионов в мембране и водных растворах Обмен сложных липидов
Обмен сложных липидов Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Этиловый спирт в жизни человека
Этиловый спирт в жизни человека Основні класи неорганічних сполук
Основні класи неорганічних сполук Органические соединения серы
Органические соединения серы Галогены. Строение атомов фтора и хлора
Галогены. Строение атомов фтора и хлора Главная подгруппа IV группы. Общая характеристика элементов
Главная подгруппа IV группы. Общая характеристика элементов Естествознание для всех. Викторина
Естествознание для всех. Викторина Дисперсные системы
Дисперсные системы Галогены. Получение и применение галогенов
Галогены. Получение и применение галогенов Автомобильные пластичные смазки
Автомобильные пластичные смазки Нітроген
Нітроген Химическая технология. Введение
Химическая технология. Введение