Содержание
- 2. Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы
- 3. Ионная химическая связь это связь, образовавшаяся за счет электростатического притяжения катионов к анионам Задание: Выпишите формулы
- 4. Водородная связь Химическая связь между положительно поляризованными атомами водорода одной молекулы (или ее части) и отрицательно
- 5. Металлическая связь связь в металлах и сплавах, которую выполняют относительно свободные электроны между ионами металлов в
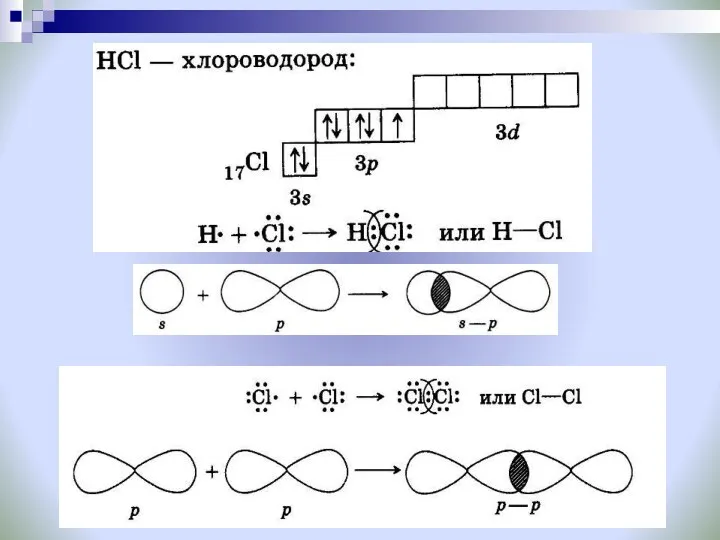
- 6. Ковалентная химическая связь это связь, возникающая между атомами за счет образования общих электронных пар Обменный Донорно-акцепторный
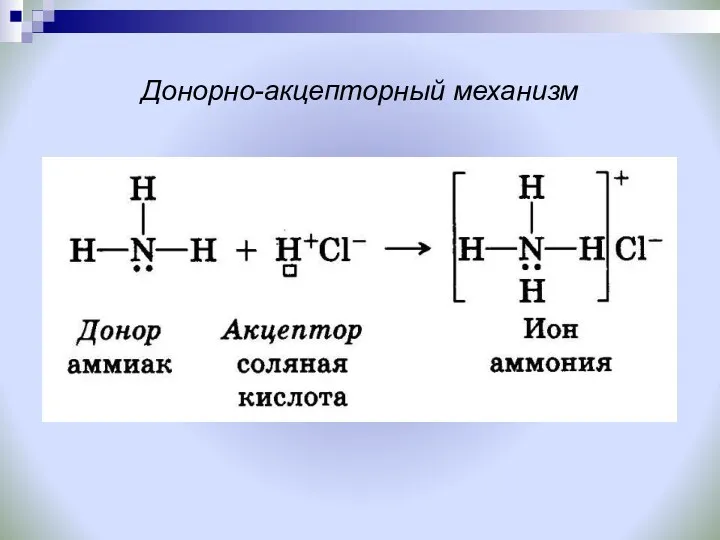
- 8. Донорно-акцепторный механизм
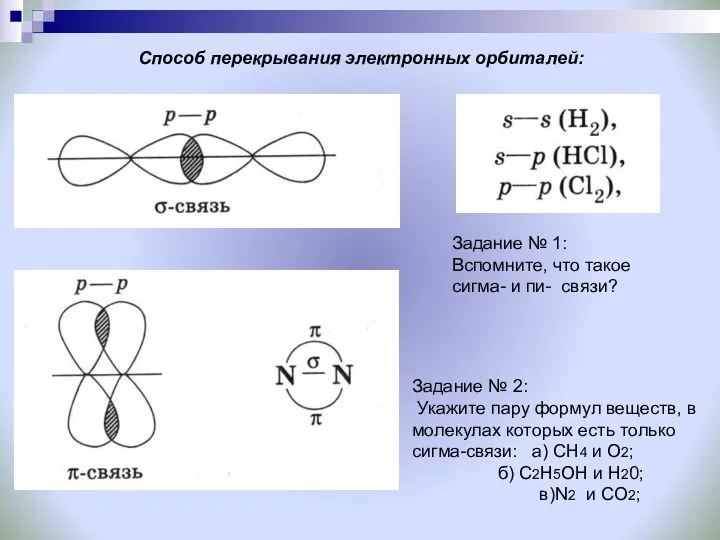
- 9. Способ перекрывания электронных орбиталей: Задание № 1: Вспомните, что такое сигма- и пи- связи? Задание №
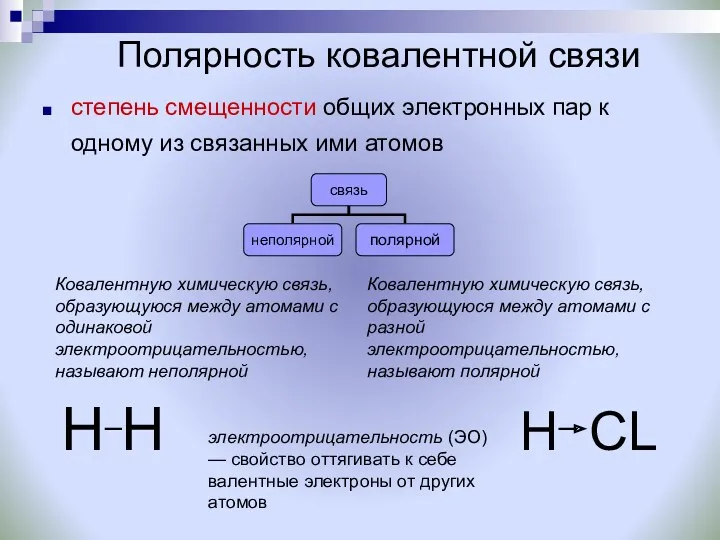
- 10. Полярность ковалентной связи степень смещенности общих электронных пар к одному из связанных ими атомов электроотрицательность (ЭО)
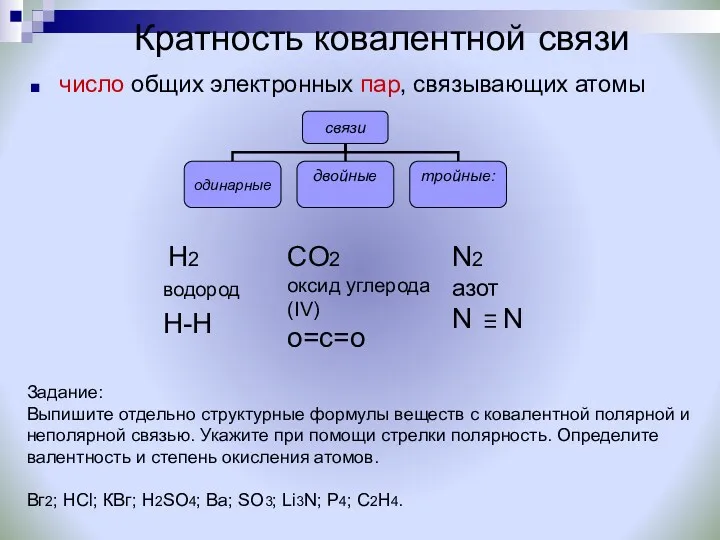
- 11. Кратность ковалентной связи число общих электронных пар, связывающих атомы CO2 оксид углерода (IV) о=с=о N2 азот
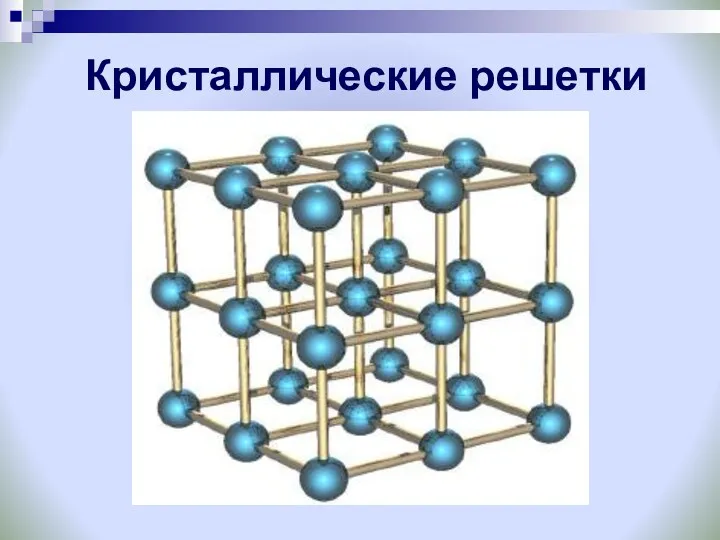
- 12. Кристаллические решетки
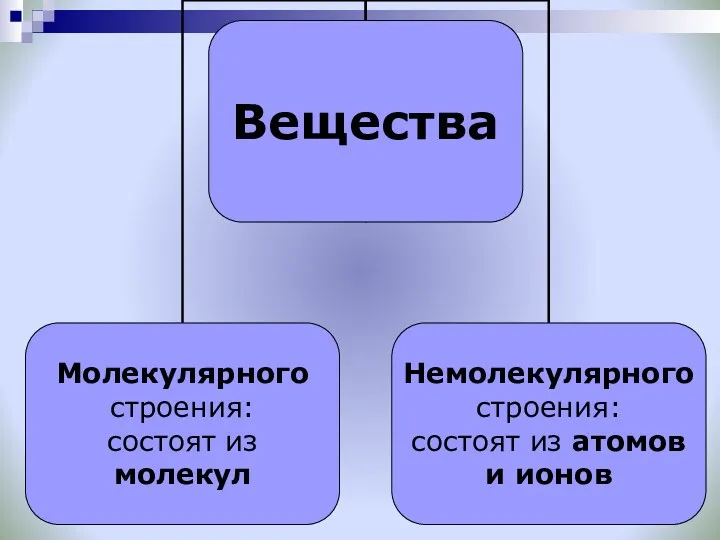
- 13. Вещество – то, из чего состоит физическое тело.
- 15. Аморфные вещества
- 16. Кристаллические вещества
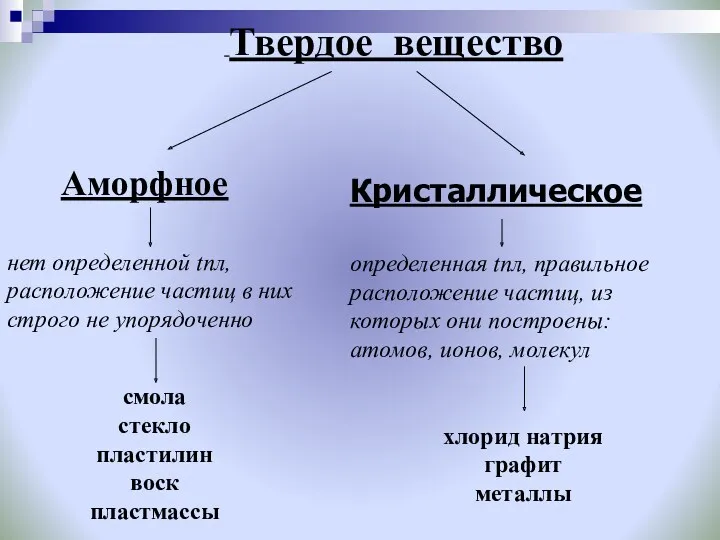
- 17. Твердое вещество Аморфное нет определенной tпл, расположение частиц в них строго не упорядоченно смола стекло пластилин
- 18. Кристаллические решётки веществ-это упорядоченное расположение частиц (атомов, молекул, ионов) в строго определённых точках пространства. Точки размещения
- 19. Вывод: Свойства веществ в твердом состоянии зависят от типа кристаллической решетки (прежде всего от того, какие
- 20. Вывод: Строение атома ЭО Вид химической связи Тип кристаллической решетки Свойства веществ
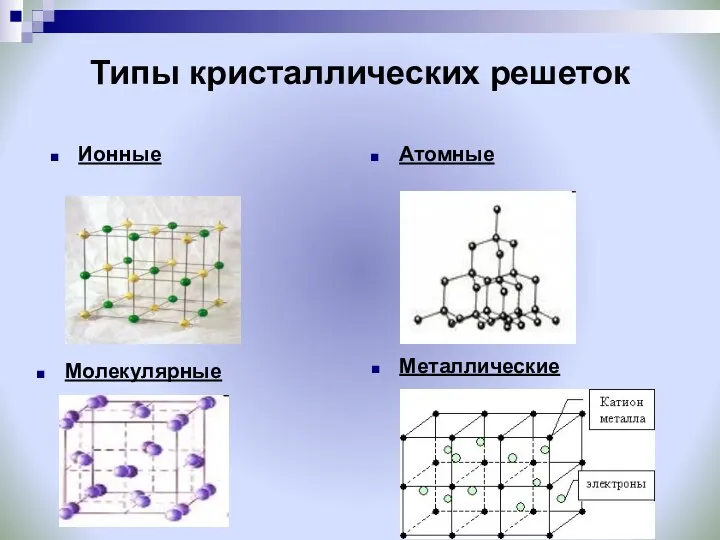
- 21. Типы кристаллических решеток Ионные Атомные Молекулярные Металлические
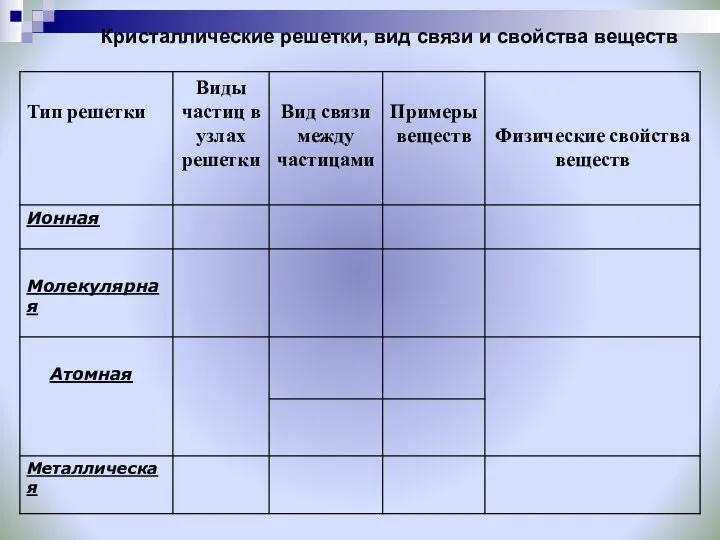
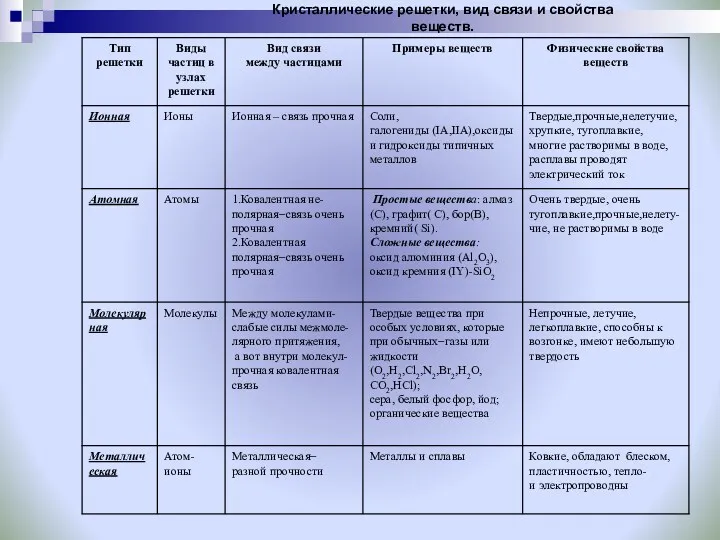
- 22. Кристаллические решетки, вид связи и свойства веществ
- 23. Ионные кристаллические решетки Ионные кристаллические решётки имеют соли, некоторые оксиды и гидроксиды металлов. Рассмотрим строение кристалла
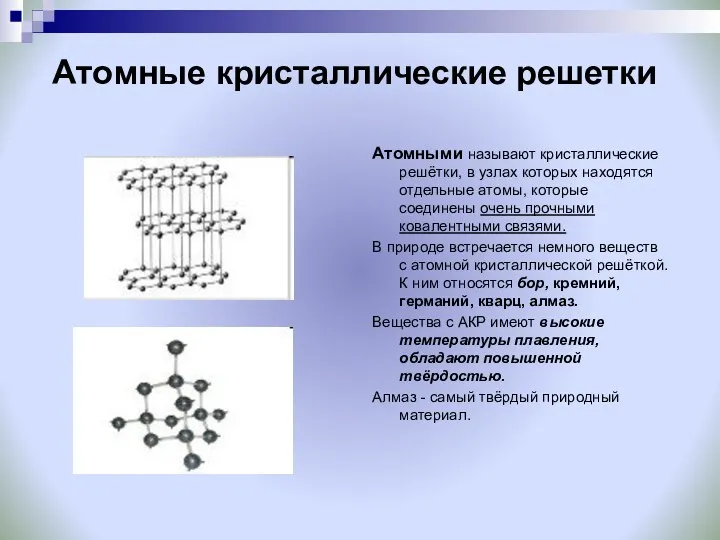
- 24. Атомные кристаллические решетки Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень
- 25. Металлические кристаллические решетки Металлическими называют решётки, в узлах которых находятся атомы и ионы металла. Для металлов
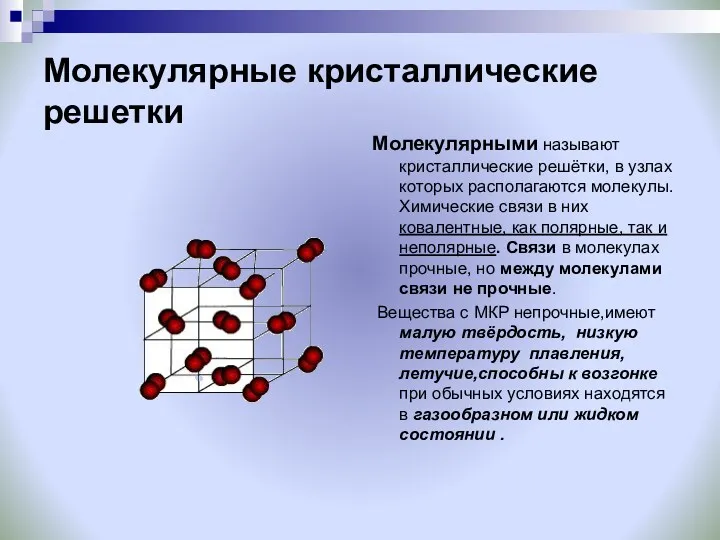
- 26. Молекулярные кристаллические решетки Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них
- 27. Кристаллические решетки, вид связи и свойства веществ.
- 28. Вывод: Существует следующая закономерность: если известно строение веществ, то можно предсказать их свойства, или наоборот: если
- 30. Закон постоянства состава Жозеф Луи Пруст. 1808 г. родился 26 сентября 1754 г. в небольшом городке
- 31. Вывод: химическая формула вещества заключает в себе большую информацию SO3: 1.Конкретное вещество− серный газ, или оксид
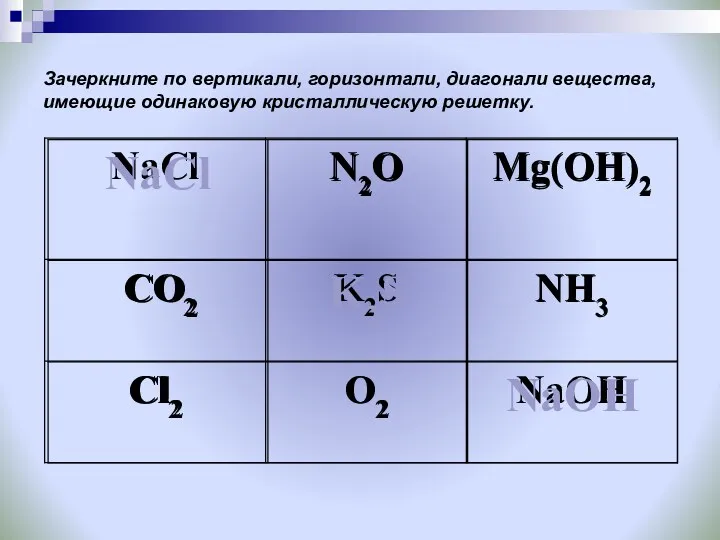
- 32. Зачеркните по вертикали, горизонтали, диагонали вещества, имеющие одинаковую кристаллическую решетку.
- 33. Продолжение задания
- 35. Скачать презентацию

















 Темір және оның қосылыстары
Темір және оның қосылыстары Химическая кинетика. Катализ. Химическое равновесие
Химическая кинетика. Катализ. Химическое равновесие Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Почему мыло пенится
Почему мыло пенится Пробоотбор других ООС. Лекция 3
Пробоотбор других ООС. Лекция 3 Спектроскопія ямр на ядрах 13с
Спектроскопія ямр на ядрах 13с Коррозия и защита полимерных строительных материалов
Коррозия и защита полимерных строительных материалов Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас
Обчислення за хімічними рівняннями відносного виходу продукту реакції. Урок №19. 11 клас Жиры
Жиры Воздух, которым мы дышим
Воздух, которым мы дышим Специфическое поведение гетерофункциональных соединений как результат взаимного влияния атомов
Специфическое поведение гетерофункциональных соединений как результат взаимного влияния атомов Методика проверки и оценивания заданий с развернутым ответом линии 30 и 31
Методика проверки и оценивания заданий с развернутым ответом линии 30 и 31 АЛЮМИНИЙ
АЛЮМИНИЙ Белки – высокомолекулярные природные соединения (биополимеры)
Белки – высокомолекулярные природные соединения (биополимеры) Растворы электролитов
Растворы электролитов Общая характеристика неметаллов
Общая характеристика неметаллов Три кити нанохімії
Три кити нанохімії Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін)
Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін) Вуглеводи прості і складні
Вуглеводи прості і складні Алкалоиды, производные тропана
Алкалоиды, производные тропана Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов
Положение в ПСХЭ водорода, лантаноидов, актиноидов и искусственно полученных элементов Алкины. Химические и физические свойства алкинов. Строение алкинов
Алкины. Химические и физические свойства алкинов. Строение алкинов В мире кристаллов
В мире кристаллов Неорганические строительные материалы. Стекло
Неорганические строительные материалы. Стекло Угольная и кремниевая кислоты и их соли
Угольная и кремниевая кислоты и их соли Металлы
Металлы Строение атома. Периодический закон
Строение атома. Периодический закон Облучение. Радиационная окраска
Облучение. Радиационная окраска