Содержание
- 2. Кіріспе Темір және оның қосылыстарының ашылу тарихы (тарихшы –ғалым) Темір және оның қосылыстарының табиғатта таралуы (геолог)
- 3. Темір. Темір десек біздің көз алдымызға шойын мен болат келеді «Жер бетінде темір жойылып кетсе, не
- 4. Ерте кездегі темірден жасалған қайшы. Ұзындығы – 15,5 см. XIV ғасырдың екінші жартысы. Ішкі құлыптың топсасы
- 5. Темірден жасалған құлып. Ұзындығы – 8,5 см. ХІІ ғасыр. Темірден жасалған кілттер
- 6. Балта. Ұзындығы – 16 см. ХІ ғасыр. Ат әбзелдері. Құрамы: темір, күміс және т.б. Ұзындығы 24
- 8. Меккедегі қара тастың өзі де таза темірден жасалғаны белгілі,оның тіреусіз қалқып тұруы магниттік қасиетіне негізделген .
- 9. Табиғатта таралуы Темір – табиғатта таралуы бойынша екінші металл. Оның жер қыртысындағы үлесі 5,1%. Көптеген метеориттердің
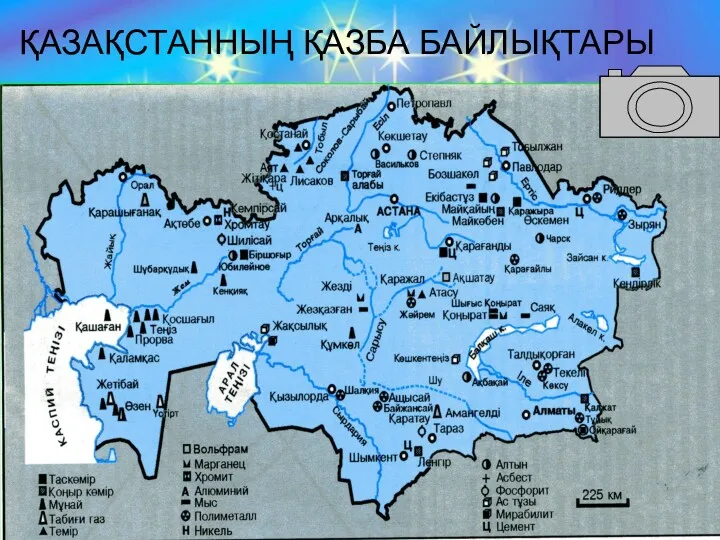
- 11. ҚАЗАҚСТАННЫҢ ҚАЗБА БАЙЛЫҚТАРЫ
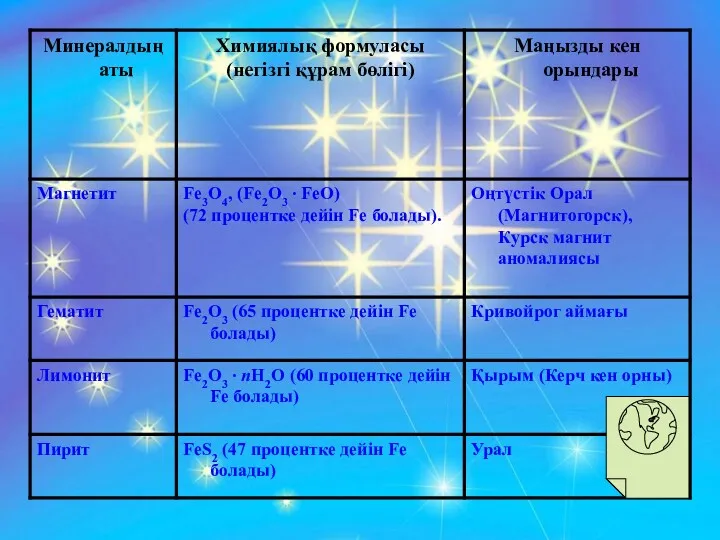
- 12. Лимонит Пирит
- 13. Магнетит Гематит
- 14. Қостанайдағы Сарыбай кен орнында ашық әдіспен темір кенін өндіру
- 15. Оралдың шығыс беткейінде, Қостанай өңірінде ( Соколов- Сарыбай), Ақтөбеде феррохром және ферросилиций зауыттары, Қарағанды да темір
- 16. Темірдің құймалары:
- 18. Темір – жылтыр, күміс түстес ақшыл металл, оның тығыздығы – 7,87 г/см3. Балқу температурасы жоғары –
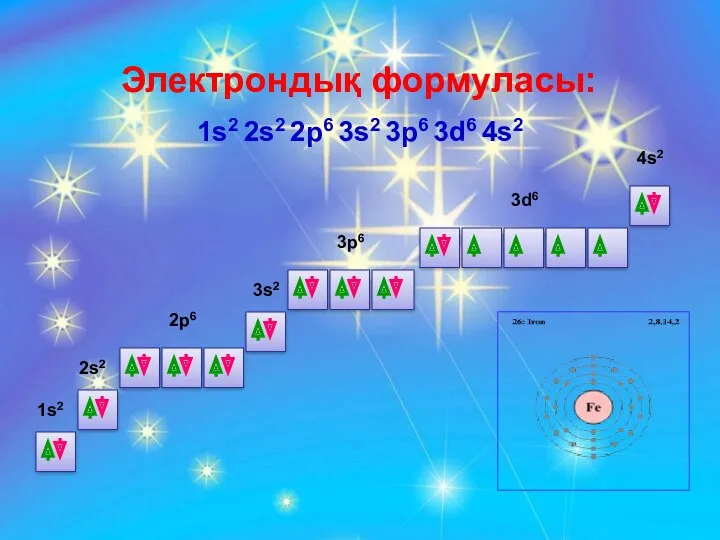
- 19. Периодтық жүйедегі орны Темірдің химиялық қасиеттері 4-период, 4 - қатар, 8 - топ, қосымша топша, реттік
- 20. Электрондық формуласы: 1s2 2s2 2p6 3s2 3p6 3d6 4s2 1s2 2s2 2p6 3s2 3p6 3d6 4s2
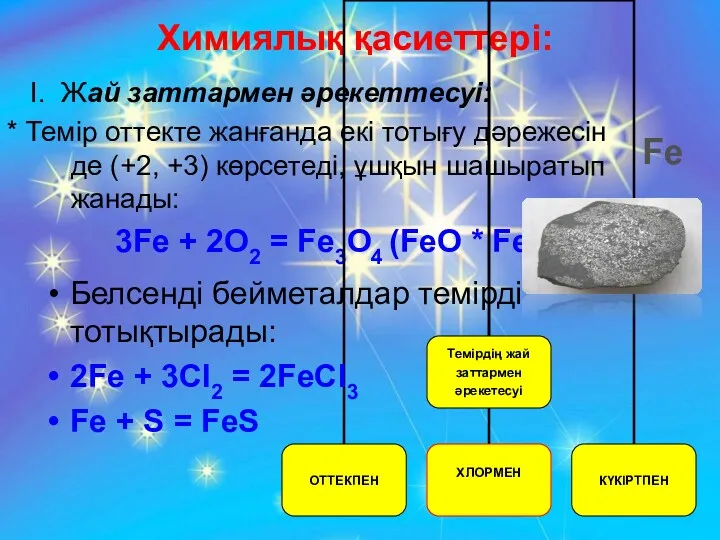
- 21. Химиялық қасиеттері: І. Жай заттармен әрекеттесуі: * Темір оттекте жанғанда екі тотығу дәрежесін де (+2, +3)
- 22. II.Күрделі заттармен әрекеттесуі: Қатты қыздырылған темір су буымен әрекеттеседі: Fe + H2O = FeO + H2
- 23. Темір химиялық реакцияларда 2 немесе 3 электрон беріп, өзінің тұрақты қосылыстарында +2 және +3 тотығу дәрежелерін
- 24. Темірді 3 түрлі әдіспен алуға болады: Пирометаллургиялық әдіспен: оксидінен тотықсыздандыру арқылы: Fe2O3 + 3H2 = 2Fe
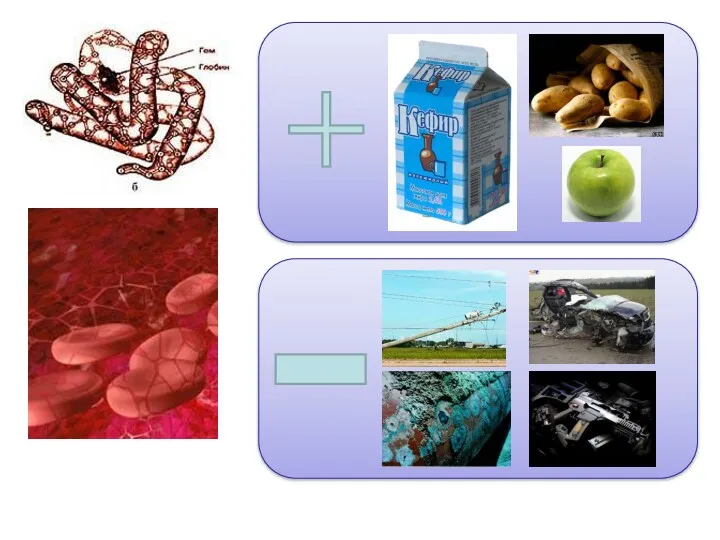
- 25. Темір тірі организмдерде де болады. Ересек адамның денесінде 4-5 грамм темір бар. Оның 65%-і қандағы гемоглобиннің
- 26. Темірдің ең көп мөлшері мына өсімдіктер мен тағамдар құрамында: қарақұмық күнбағыс петрушка бұршақ жүзім қалақай
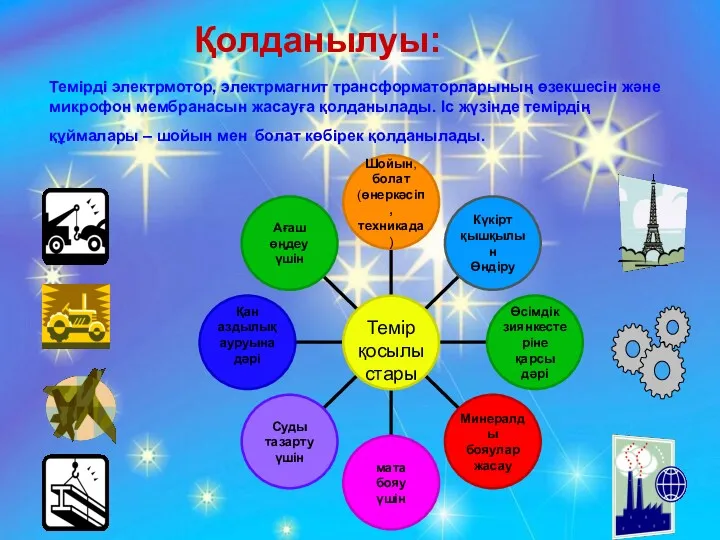
- 28. Қолданылуы: Темірді электрмотор, электрмагнит трансформаторларының өзекшесін және микрофон мембранасын жасауға қолданылады. Іс жүзінде темірдің құймалары –
- 29. Әдебиетпен: Қорқыт атаның кітабында, «Оғыз наме » туындысында, « Бозжігіт » дастанында , « Сәйдул мәлік
- 30. Бағалау Үйге тапсырма: §40-41 Темір және оның қосылыстары
- 32. Скачать презентацию






















 Электролитическая диссоциация
Электролитическая диссоциация Синтез нуклеотидов
Синтез нуклеотидов Строение атома. 8 класс
Строение атома. 8 класс Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы
Углеводороды. Предельные нециклические (ациклические) углеводороды. Алканы Атомы, молекулы и ионы
Атомы, молекулы и ионы Классификация карбоновых кислот. (Лекция 12)
Классификация карбоновых кислот. (Лекция 12) Кристаллические решетки. Кристаллические вещества
Кристаллические решетки. Кристаллические вещества Гидролиз. Необратимый гидролиз
Гидролиз. Необратимый гидролиз Нефть. Лекция 5
Нефть. Лекция 5 Распределение электронов в атомах. 8 класс
Распределение электронов в атомах. 8 класс Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов
Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов Модифицированные природные полимеры. Их свойства
Модифицированные природные полимеры. Их свойства Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год
Повышение эффективности производства изопропилбензола за счёт нового катализатора, производительность по кумолу 100500 т/год Электрохимический ряд напряжений металлов
Электрохимический ряд напряжений металлов Серная кислота
Серная кислота Дисперсные системы
Дисперсные системы Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною
Виведення молекулярної формули речовини за загальною формулою гомологічного ряду та густиною або відносною густиною Металдарға жалпы сипаттама
Металдарға жалпы сипаттама Хімічний елемент Літій
Хімічний елемент Літій Углеводороды ациклические, циклические
Углеводороды ациклические, циклические Классификация химических элементов
Классификация химических элементов Механизмы реакций органических соединений
Механизмы реакций органических соединений Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие
Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие Химия и продукты питания
Химия и продукты питания Кристаллические решетки
Кристаллические решетки Азот қышқылы
Азот қышқылы Общие свойства металлов
Общие свойства металлов Виды химических связей и типы кристаллических решеток
Виды химических связей и типы кристаллических решеток