Содержание
- 2. Типы реагентов в органической химии Нуклеофильные реагенты: анионы, карбанионы, частицы с электронной парой. OH-, CN-, NO2-,
- 3. Радикальное замещение - Sr (Алканы) Радикалы – высокоактивные частицы с неспаренными электронами. CH4 + Cl2→CH3Cl+HCl Механизм
- 4. Электрофильное присоединение – AE (алкены) Механизм электрофильного присоединение: Поляризация связи Br-Br и образование π-комплекса: Образование σ-комплекса
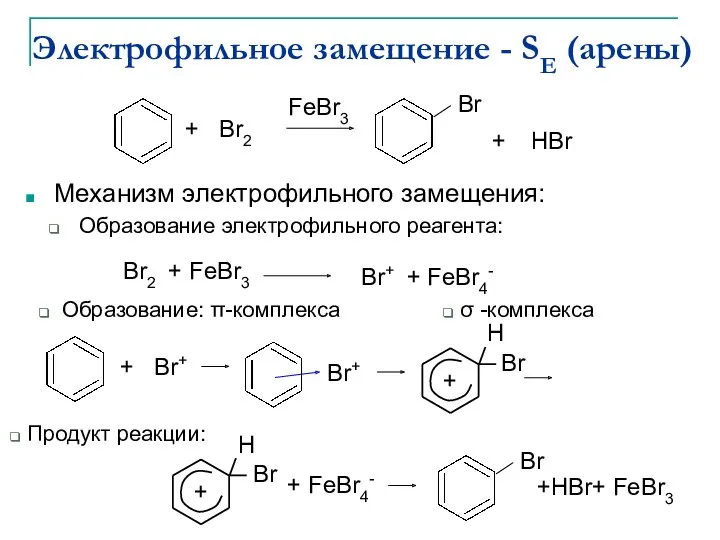
- 5. Электрофильное замещение - SE (арены) Механизм электрофильного замещения: Образование электрофильного реагента: Образование: π-комплекса Продукт реакции: σ
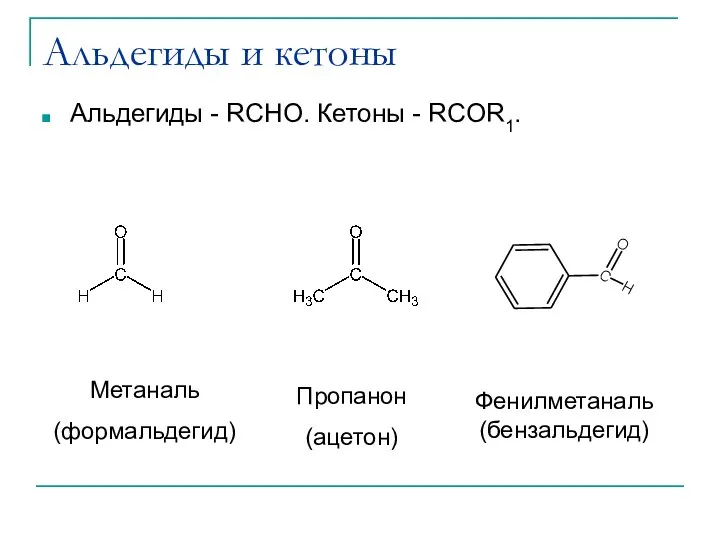
- 6. Альдегиды и кетоны Альдегиды - RCHO. Кетоны - RCOR1. Пропанон (ацетон) Фенилметаналь (бензальдегид) Метаналь (формальдегид)
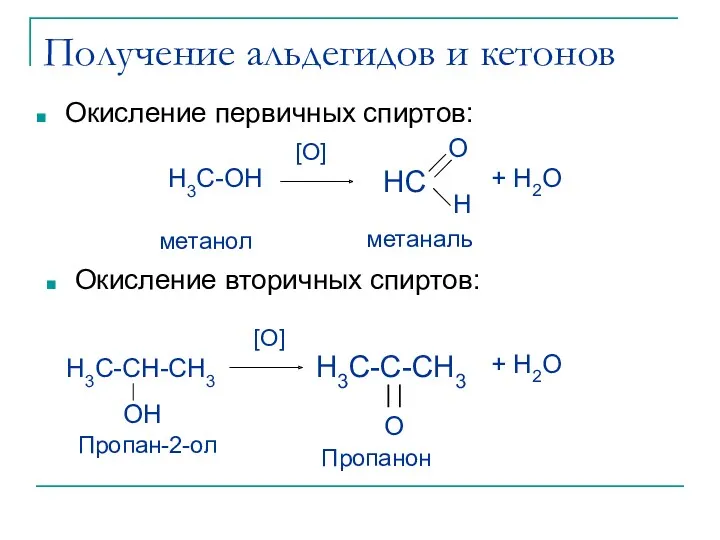
- 7. Получение альдегидов и кетонов Окисление первичных спиртов: Окисление вторичных спиртов:
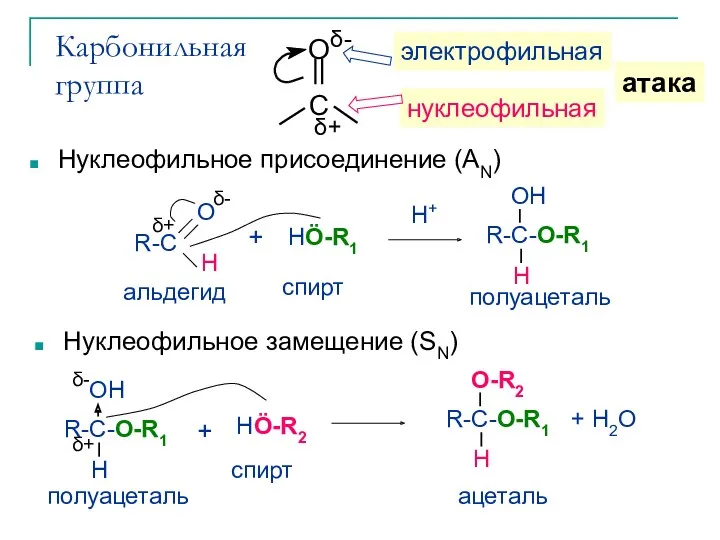
- 8. Карбонильная группа Нуклеофильное присоединение (AN) Нуклеофильное замещение (SN)
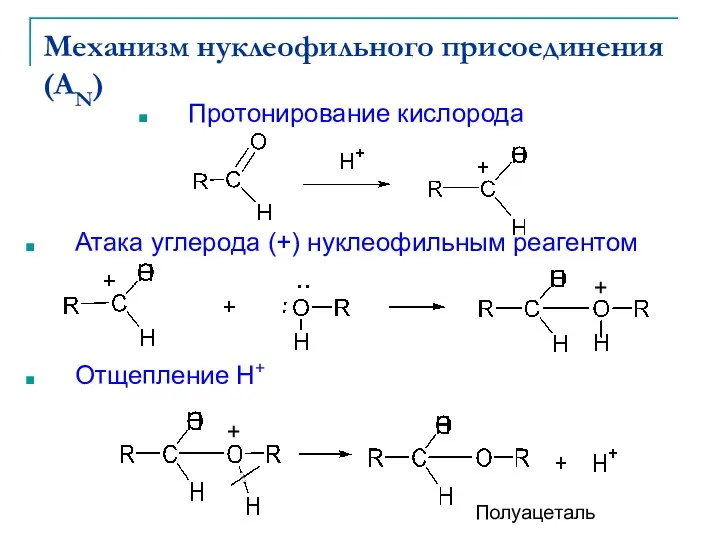
- 9. Механизм нуклеофильного присоединения (AN) Протонирование кислорода Атака углерода (+) нуклеофильным реагентом Отщепление Н+ Полуацеталь
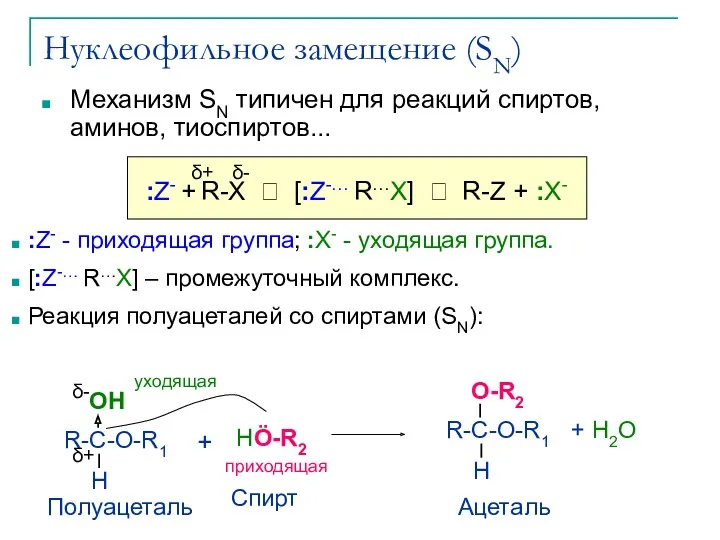
- 10. Нуклеофильное замещение (SN) Механизм SN типичен для реакций спиртов, аминов, тиоспиртов... :Z- - приходящая группа; :X-
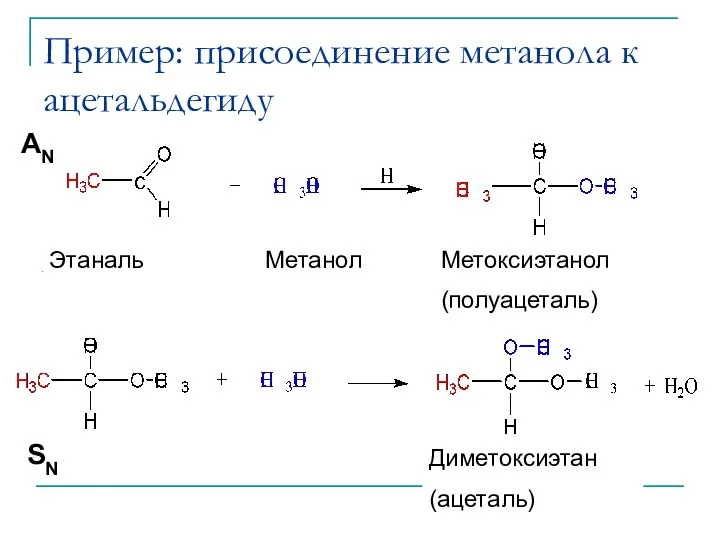
- 11. Пример: присоединение метанола к ацетальдегиду (Hemiacetal) (Acetal) AN SN Этаналь Метанол Метоксиэтанол (полуацеталь) Диметоксиэтан (ацеталь)
- 12. Углеводы Моносахариды Дисахариды Полисахариды
- 13. Углеводы (сахара) Углеводы широко распространены в растительном и животном мире. Основной источник углеводов – это растения,
- 14. Углеводы Углеводы – это гетерофункциональные органические соединения, содержащие несколько спиртовых групп и карбонильную группу (альдегидную или
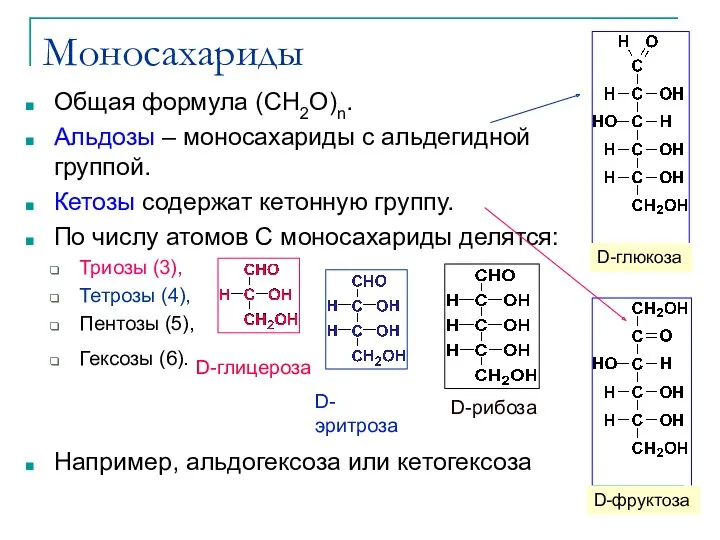
- 15. Моносахариды Общая формула (CH2O)n. Альдозы – моносахариды с альдегидной группой. Кетозы содержат кетонную группу. По числу
- 16. Основной тип изомерии моносахаридов – это стереоизомерия. Стереоизмеры отличаются различным пространственным расположением атомов или функциональных групп.
- 17. Оптическая изомерия Стереоизомеры, которые являются зеркальными отображениями, называются энантиомерами. Энантиомеры обладают одинаковыми химическими и физическими свойствами
- 18. Формулы Фишера (Fisher projection) Структура моносахаридов на плоскости представляется с помощью формул Фишера. Положение заместителей при
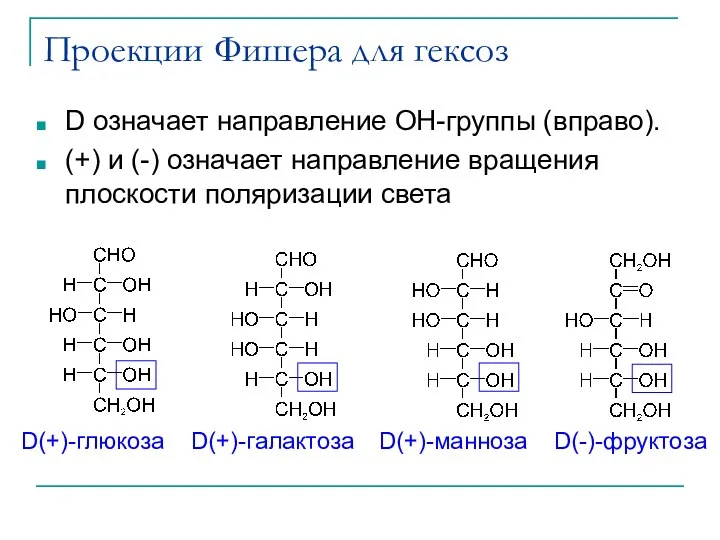
- 19. Проекции Фишера для гексоз D означает направление OH-группы (вправо). (+) и (-) означает направление вращения плоскости
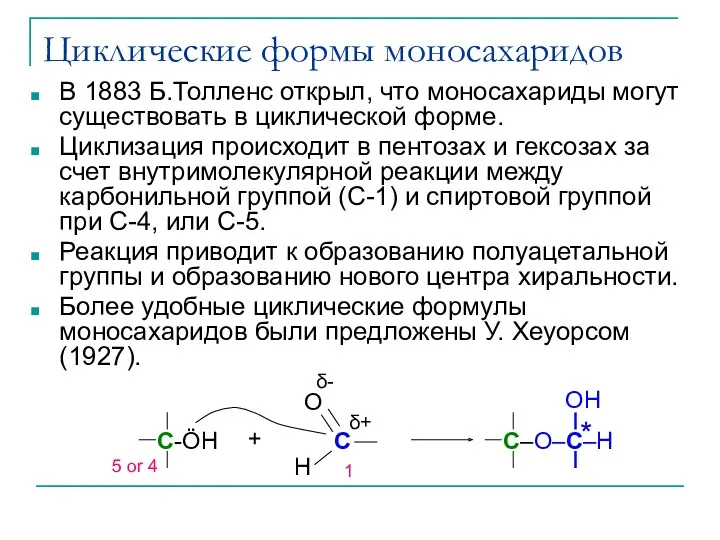
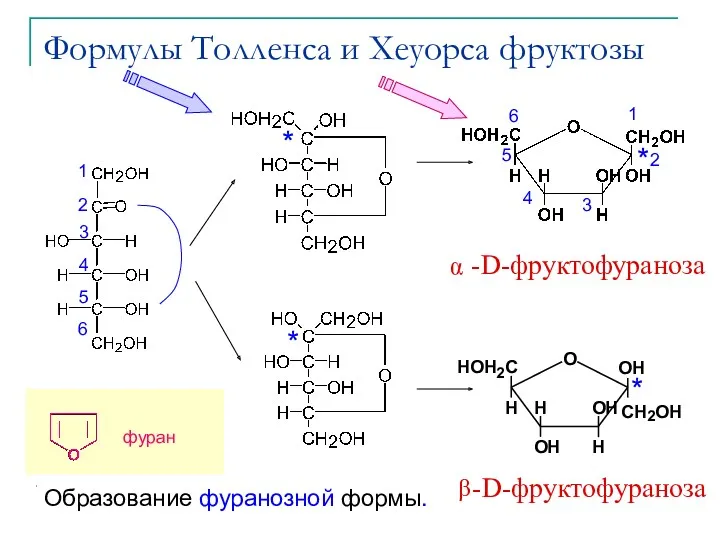
- 20. Циклические формы моносахаридов В 1883 Б.Толленс открыл, что моносахариды могут существовать в циклической форме. Циклизация происходит
- 21. Формулы Толленса и Хеуорса
- 22. Правила написания формул Хеуорса Возможно образование только 5-членных циклов (фуранозная форма) и 6-членных циклов (пиранозная форма).
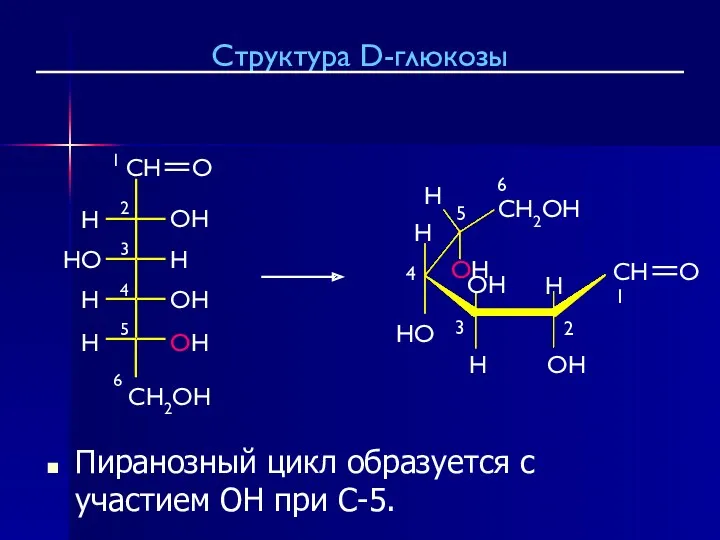
- 23. Пиранозный цикл образуется с участием OH при C-5. Структура D-глюкозы
- 24. поворот C(4)-C(5) вокруг линии связи для благоприятной ориентации OH Структура D-глюкозы
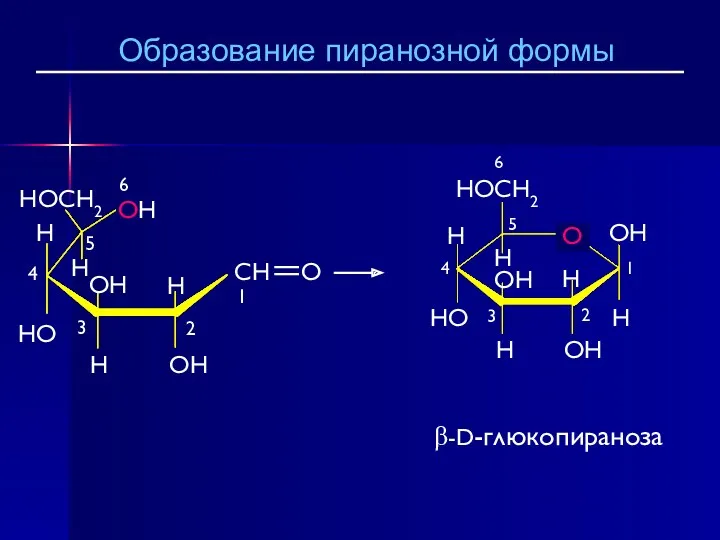
- 25. β-D-глюкопираноза Образование пиранозной формы
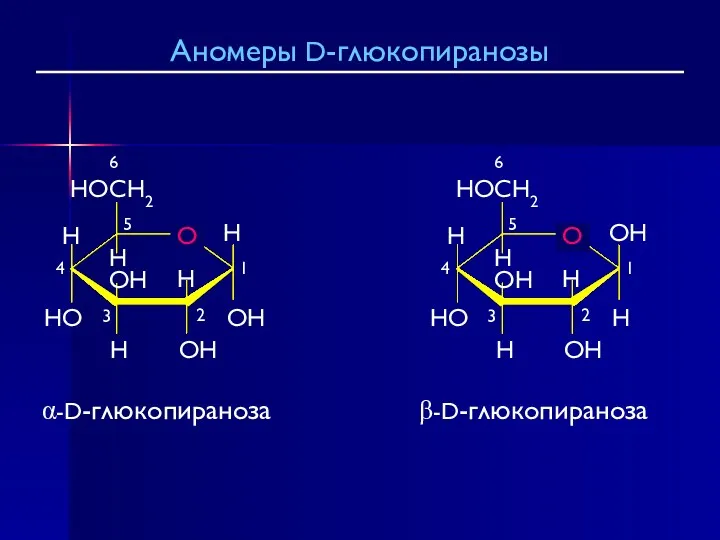
- 26. β-D-глюкопираноза α-D-глюкопираноза Аномеры D-глюкопиранозы
- 27. Формулы Толленса и Хеуорса фруктозы
- 28. Мутаротация В водном растворе устанавливается равновесие между циклическими и линейными структурами моносахаридов, которое носит название мутаротация.
- 29. Гликозидная связь. O-гликозиды. Гликозиды содержат заместители, отличающиеся от ОН в аномерном центре. O-гликозиды образуются при реакции
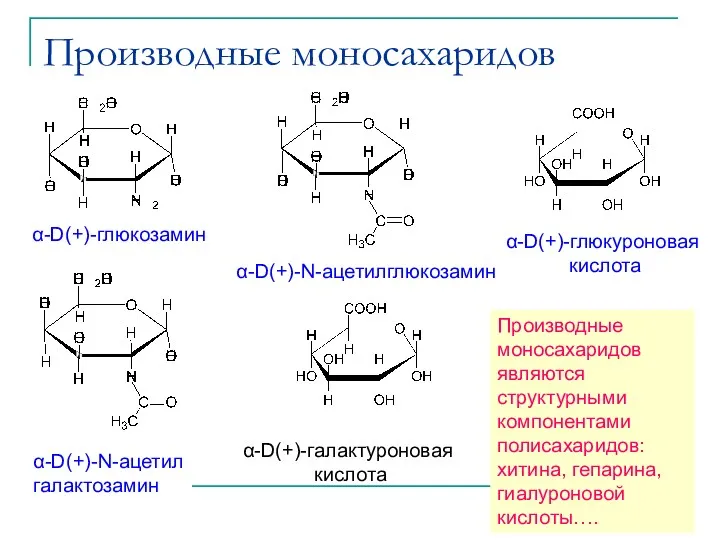
- 30. Производные моносахаридов α-D(+)-глюкозамин α-D(+)-N-ацетилглюкозамин α-D(+)-N-ацетил галактозамин α-D(+)-глюкуроновая кислота α-D(+)-галактуроновая кислота Производные моносахаридов являются структурными компонентами полисахаридов:
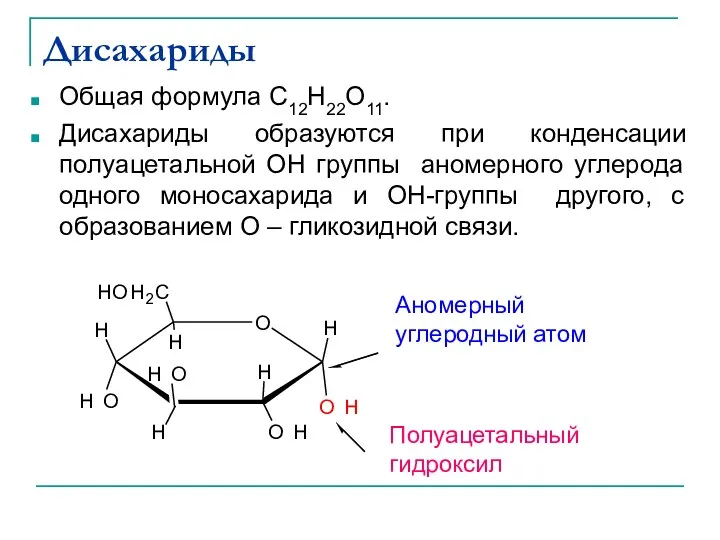
- 31. Дисахариды Общая формула C12H22O11. Дисахариды образуются при конденсации полуацетальной ОН группы аномерного углерода одного моносахарида и
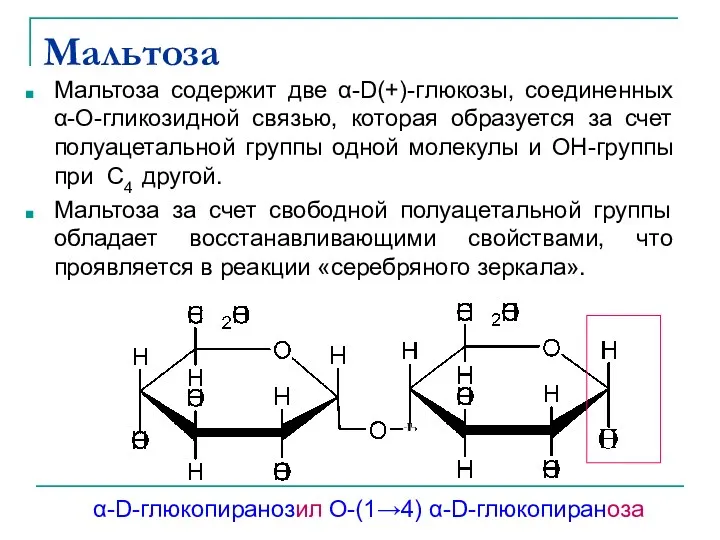
- 32. Мальтоза Мальтоза содержит две α-D(+)-глюкозы, соединенных α-О-гликозидной связью, которая образуется за счет полуацетальной группы одной молекулы
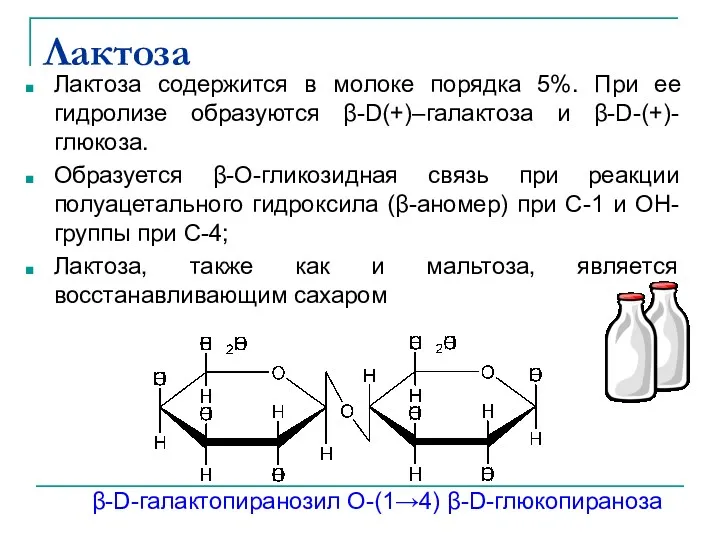
- 33. Лактоза Лактоза содержится в молоке порядка 5%. При ее гидролизе образуются β-D(+)–галактоза и β-D-(+)-глюкоза. Образуется β-О-гликозидная
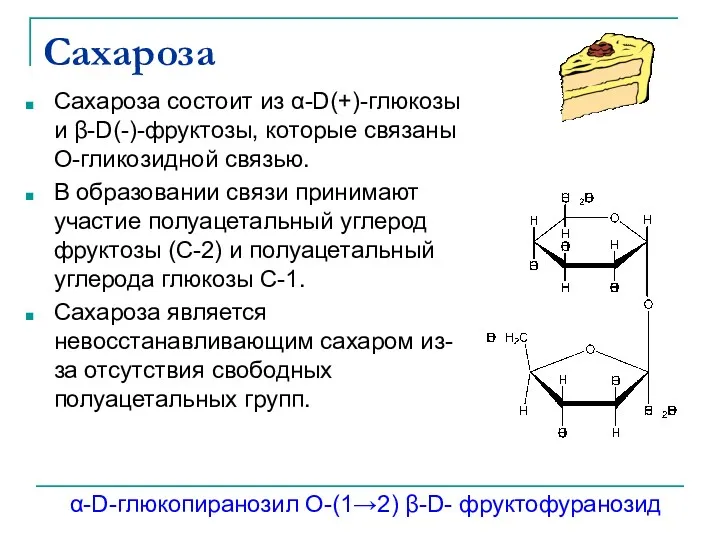
- 34. Сахароза Сахароза состоит из α-D(+)-глюкозы и β-D(-)-фруктозы, которые связаны О-гликозидной связью. В образовании связи принимают участие
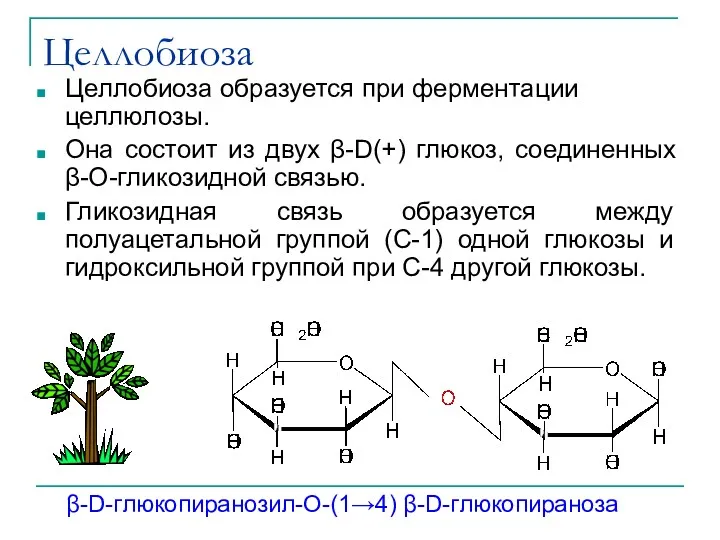
- 35. Целлобиоза Целлобиоза образуется при ферментации целлюлозы. Она состоит из двух β-D(+) глюкоз, соединенных β-О-гликозидной связью. Гликозидная
- 36. Полисахариды Общая формула (C6H10O5)n. Полисахариды делятся на: Гомополисахариды (крахмал, целлюлоза, гликоген, хитин), состоящие только из одного
- 37. Гомополисахариды Крахмал - состоит из двух компонентов: амилозы, растворимой в воде (15-20%), и амилопектина, нерастворимого в
- 38. Структура амилозы α-(1→4) гликозидная связь
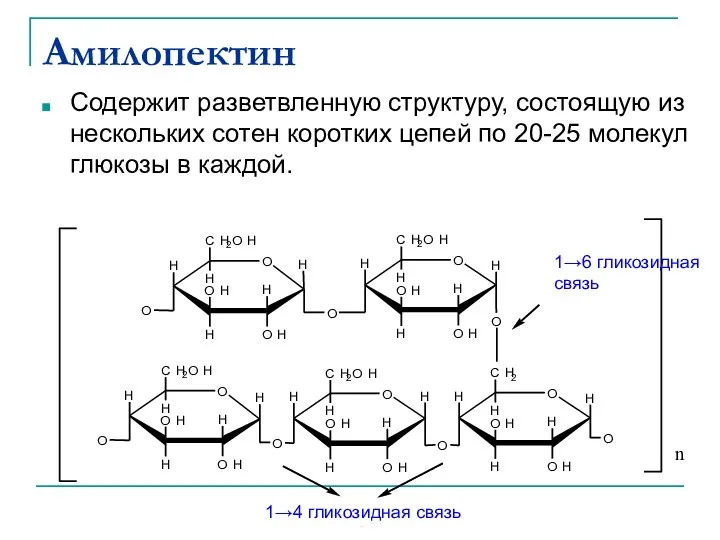
- 39. Амилопектин Содержит разветвленную структуру, состоящую из нескольких сотен коротких цепей по 20-25 молекул глюкозы в каждой.
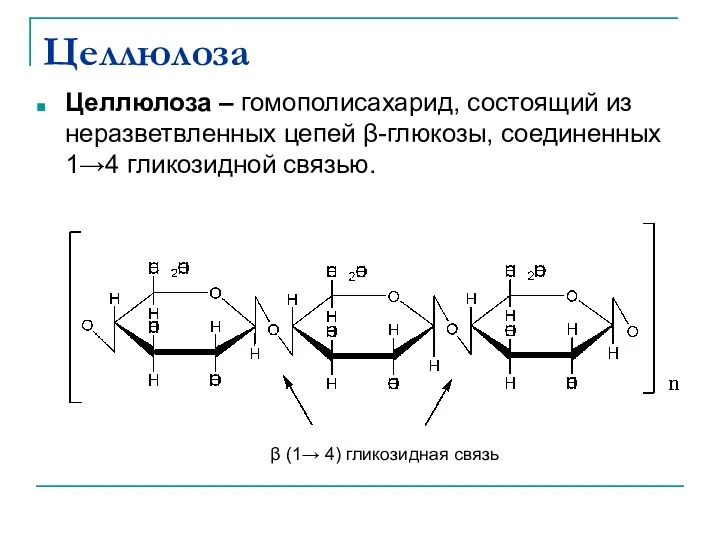
- 40. Целлюлоза Целлюлоза – гомополисахарид, состоящий из неразветвленных цепей β-глюкозы, соединенных 1→4 гликозидной связью. β (1→ 4)
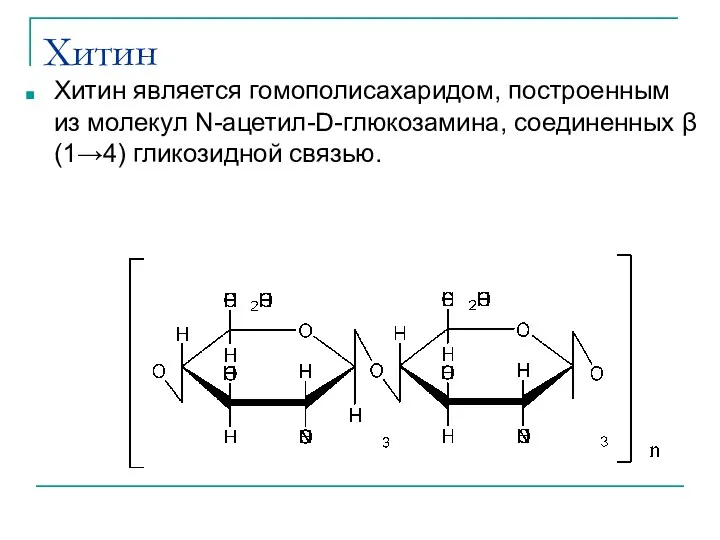
- 41. Хитин Хитин является гомополисахаридом, построенным из молекул N-ацетил-D-глюкозамина, соединенных β (1→4) гликозидной связью.
- 42. Гетерополисахариды Гетерополисахариды построены из различных моносахаридов и их производных. Гиалуроновая кислота (β-глюкуроновая кислота и N-ацетил глюкозамин).
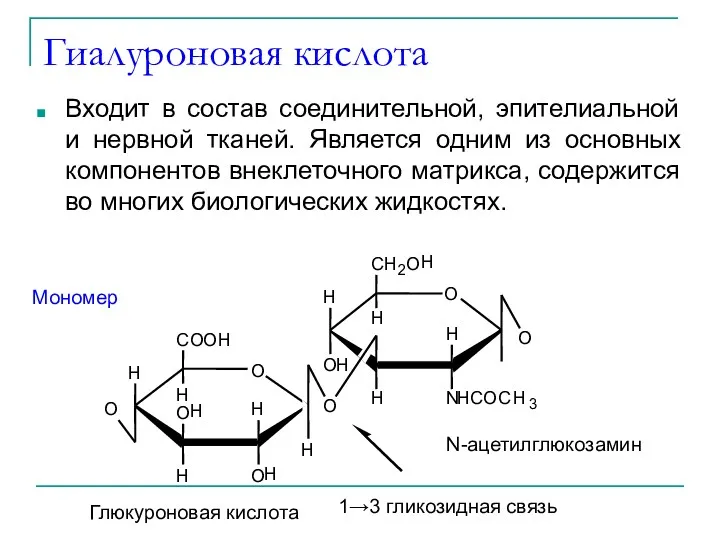
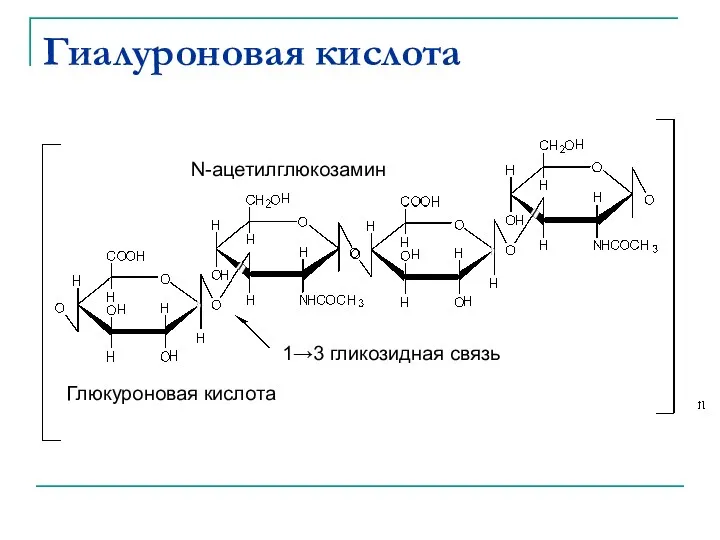
- 43. Гиалуроновая кислота Входит в состав соединительной, эпителиальной и нервной тканей. Является одним из основных компонентов внеклеточного
- 44. Гиалуроновая кислота
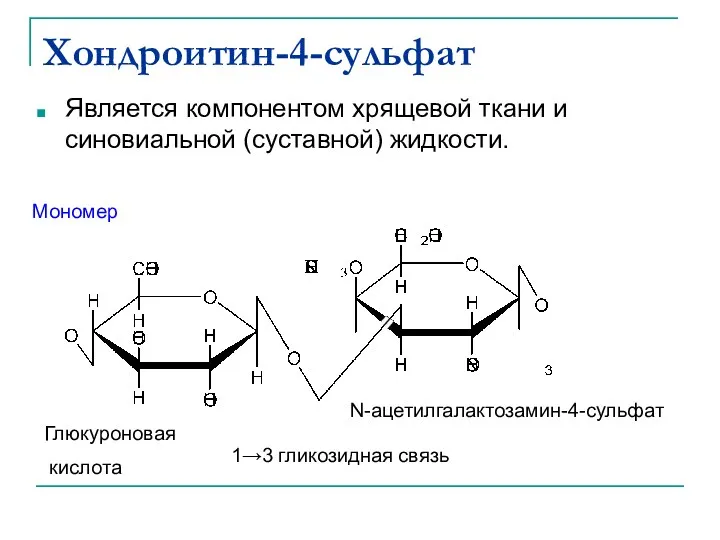
- 45. Хондроитин-4-сульфат Является компонентом хрящевой ткани и синовиальной (суставной) жидкости. Мономер Глюкуроновая кислота 1→3 гликозидная связь N-ацетилгалактозамин-4-сульфат
- 47. Скачать презентацию


















 СОҢҒЫ СТ ДАЙЫНДЫҚ!
СОҢҒЫ СТ ДАЙЫНДЫҚ! Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Алюминий и его соединения
Алюминий и его соединения Строение атома. Тема 2
Строение атома. Тема 2 Бензол молекуласында байланыстардың түзілу сызбанұсқасы
Бензол молекуласында байланыстардың түзілу сызбанұсқасы Классификация органических соединений. Тема 8
Классификация органических соединений. Тема 8 Химия и обмен углеводов. Функции углеводов
Химия и обмен углеводов. Функции углеводов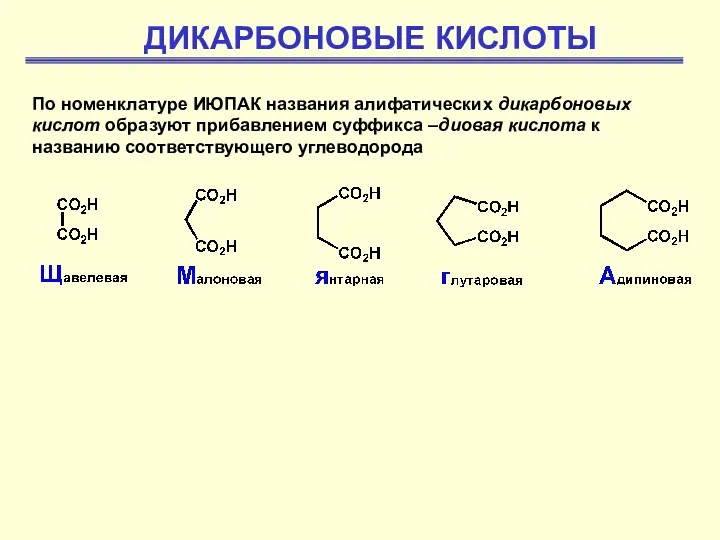 Дикарбоновые кислоты
Дикарбоновые кислоты Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів
Функціональні похідні аліфатичних вуглеводнів галогенопохідні вуглеводнів Қоспаларды бөлу әдістері
Қоспаларды бөлу әдістері Углерод
Углерод Органическая химия
Органическая химия Амины. Номенклатура аминов
Амины. Номенклатура аминов Химическая промышленность Донецкой области
Химическая промышленность Донецкой области Основные понятия, классификация, структура и свойства полимеров. (Лекция 1)
Основные понятия, классификация, структура и свойства полимеров. (Лекция 1) Установка изомеризации пентан гексановой фракции
Установка изомеризации пентан гексановой фракции Химия нефти и газа
Химия нефти и газа Галогенопроизводные углеводородов (3)
Галогенопроизводные углеводородов (3) Методические рекомендации по изучению курса Коррозия и защита металлов
Методические рекомендации по изучению курса Коррозия и защита металлов Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Соли, их классификация и свойства
Соли, их классификация и свойства Теория электролитической диссоциации
Теория электролитической диссоциации 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Основные понятия органической химии
Основные понятия органической химии Химия и пища». «Белок – основа жизни
Химия и пища». «Белок – основа жизни Массовая доля элемента в сложном веществе
Массовая доля элемента в сложном веществе Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар
Органикалық қосылыстар құрылысының теориялық негіздері және олардың реакцияға қабілеттілігін анықтаушы факторлар Галогены. Историческая справка
Галогены. Историческая справка