Содержание
- 2. Строение атома
- 3. Атом – наименьшая (неделимая химическим путем) часть элемента, сохраняющая все свойства, определенные зарядом ядра и электронной
- 4. Планетарная модель атома Атом – электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных
- 5. Составная часть вещества, содержащая одинаковые атомы, называется химическим элементом. Атомный номер Z – равен числу протонов
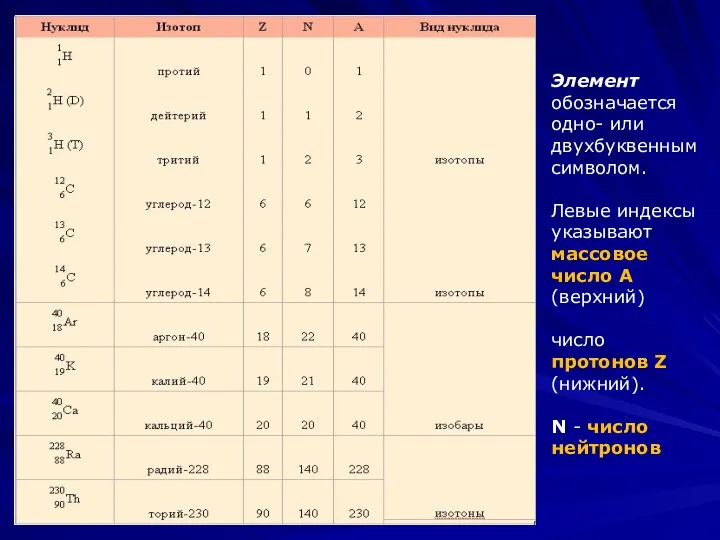
- 6. . Элемент обозначается одно- или двухбуквенным символом. Левые индексы указывают массовое число A (верхний) число протонов
- 7. Атомная масса – масса атома в атомных единицах массы (а. е. м.). Атомная единица массы определяется
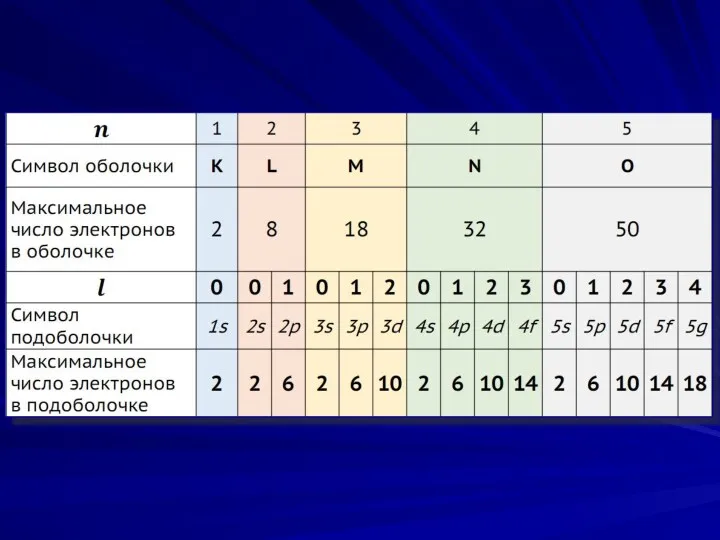
- 8. Квантовые числа Энергетическое состояние каждого электрона в атоме описывают с помощью четырех квантовых чисел: n, l,
- 9. n - главное квантовое число определяет полный запас энергии электрона и размер электронной орбитали. принимает целые
- 10. l - побочное (орбитальное) квантовое число Устанавливает подуровень энергии и форму атомной орбитали. Принимает целые значения
- 11. ml - магнитное квантовое число Определяет пространственное расположение атомной орбитали Принимает целые значения от –l до
- 12. Состояние электрона в атоме, характеризующееся определенными значениями квантовых чисел n, l, ml, т.е. определенными размерами, формой
- 14. Изображение s-, p-, d- и f-орбиталей
- 15. s-орбитали сферически симметричны для любого n и отличаются друг от друга только размером сферы. Их максимально
- 16. d-орбитали определяются квантовым числом l = 2 (n ≥ 3), при котором ml = –2, –1,
- 17. ms -спиновое квантовое число Экспериментально установлено, что электрон имеет еще одно свойство – спин. Спин определяет
- 18. Принцип наименьшей энергии При застройке атома каждый электрон размещается на той орбитали, которой соответствует минимальное значение
- 19. Принцип Паули В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел,
- 20. Последовательность застройки электронной оболочки многоэлектронного атома подчиняется следующим эмпирическим правилам: на последнем энергетическом уровне не должно
- 21. Правило Хунда (Гунда): Суммарное спиновое число электронов данного уровня должно быть максимальным Иными словами, АО данного
- 22. правилa Клечковского 1. Минимумом энергии обладают обитали с наименьшей суммой главного и побочного квантовых чисел n+l.
- 23. правилa Клечковского 2. При одинаковых значениях суммы n+l меньшей энергией обладает орбиталь с меньшим значением главного
- 24. Энергия атомных орбиталей возрастает согласно ряду 1s
- 27. Скачать презентацию






















 Дослідження якісного складу солей. Практична робота №1
Дослідження якісного складу солей. Практична робота №1 Арены. Бензол. Урок химии. 10 класс
Арены. Бензол. Урок химии. 10 класс Зелёная химия
Зелёная химия Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Свойства органических соединений
Свойства органических соединений Коллигативные свойства растворов
Коллигативные свойства растворов Драгоценные камни
Драгоценные камни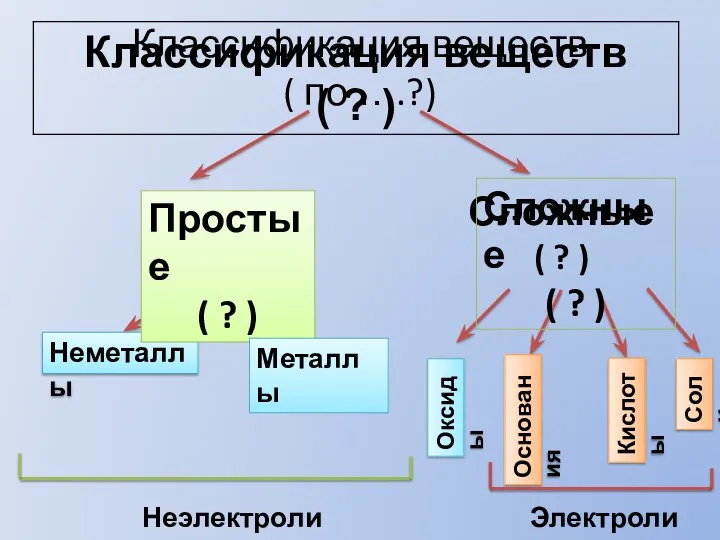 Классификация веществ
Классификация веществ Титриметрический анализ
Титриметрический анализ Минералды тыңайтқыштар өндірісі
Минералды тыңайтқыштар өндірісі Білки як високомолекулярні сполуки
Білки як високомолекулярні сполуки Аминокилоты. Свойства
Аминокилоты. Свойства Синтетические моющие средства
Синтетические моющие средства Закономерности химических реакций. (Лекция 3)
Закономерности химических реакций. (Лекция 3) Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Адсорбция. Механизм адсорбции
Адсорбция. Механизм адсорбции Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Основные понятия и законы химии
Основные понятия и законы химии Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Амины. Понятие об аминах. Анилин как органическое основание
Амины. Понятие об аминах. Анилин как органическое основание Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Арены
Арены Липиды (Жиры)
Липиды (Жиры) Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства Ұшқыш уларды оқшаулауды теориялық негіздеу
Ұшқыш уларды оқшаулауды теориялық негіздеу Капиллярная конденсация
Капиллярная конденсация Количественное определение лекарственных веществ
Количественное определение лекарственных веществ