Содержание
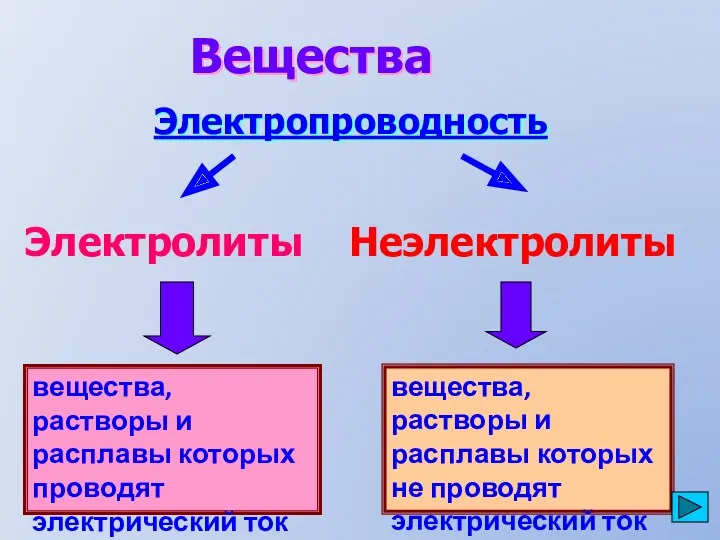
- 2. вещества, растворы и расплавы которых проводят электрический ток Вещества Электропроводность Электролиты Неэлектролиты вещества, растворы и расплавы
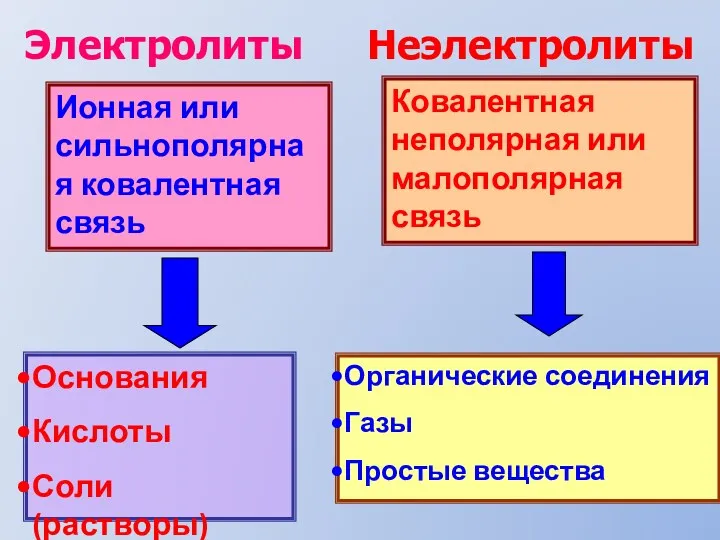
- 3. Ионная или сильнополярная ковалентная связь Основания Кислоты Соли(растворы) Ковалентная неполярная или малополярная связь Органические соединения Газы
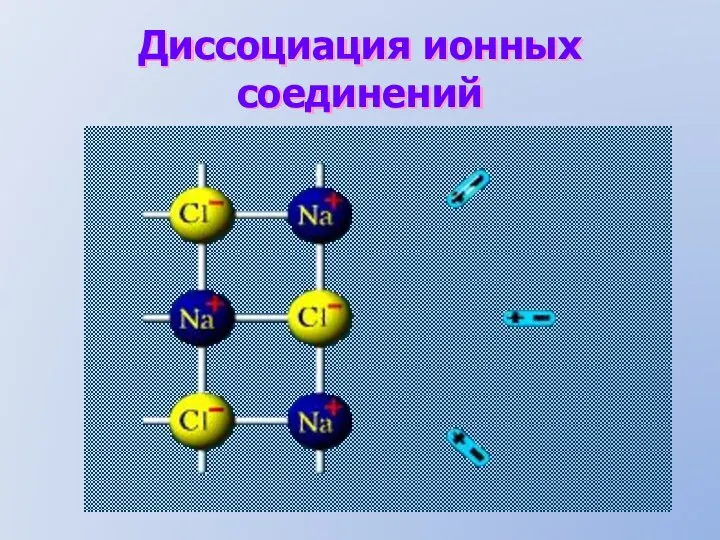
- 4. Диссоциация ионных соединений
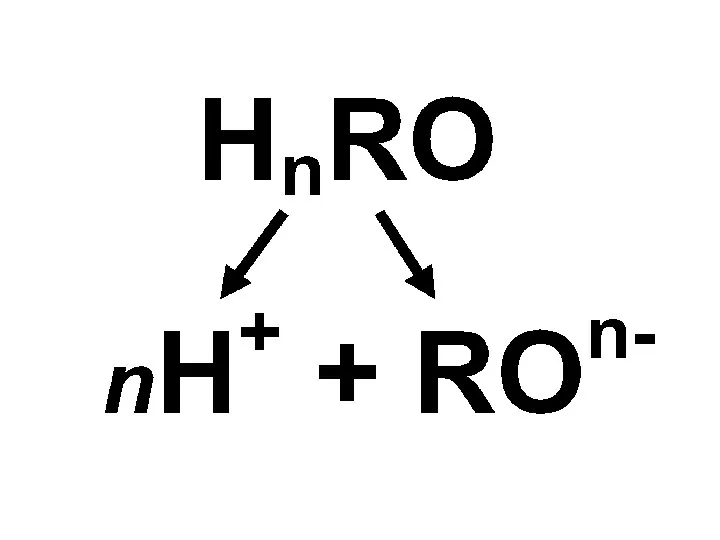
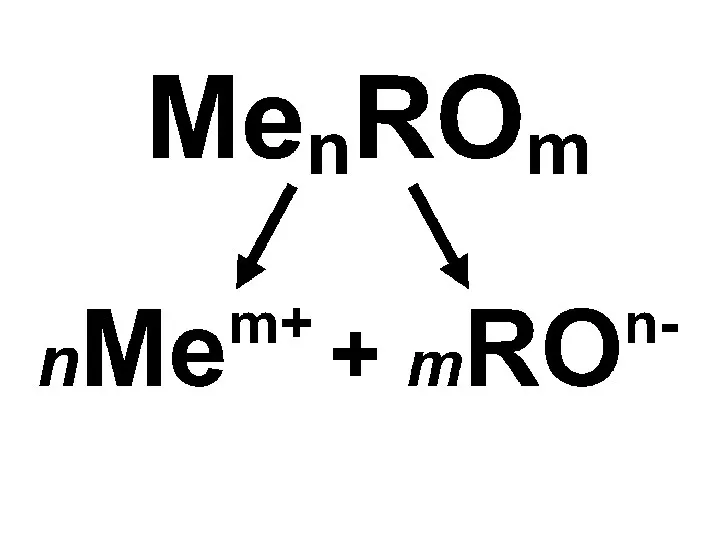
- 5. Диссоциация соединений с ковалентной полярной связью
- 6. Электролиты α ‹3% К+ⁿА-ṁ →К+ⁿ А-ṁ α ›30% К+ⁿА-ṁ →К+ⁿ + А-ṁ (н) – соли (н)
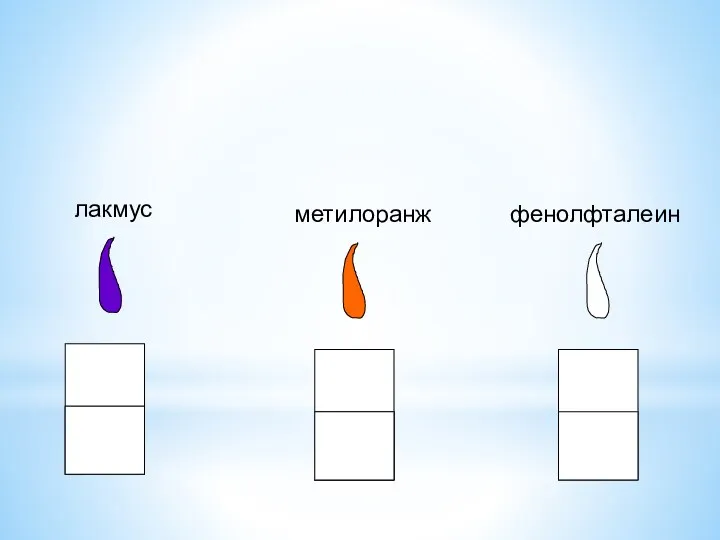
- 9. лакмус метилоранж фенолфталеин
- 11. О2 NaCl K2SO4 CaCO3 H2SO4 NaOH Mg(NO3)2 CO2 FeCl3 SО3 Ca(OH)2 Al(NO3)3 CuCl2 BaSO4 Cu(OH)2 H2O
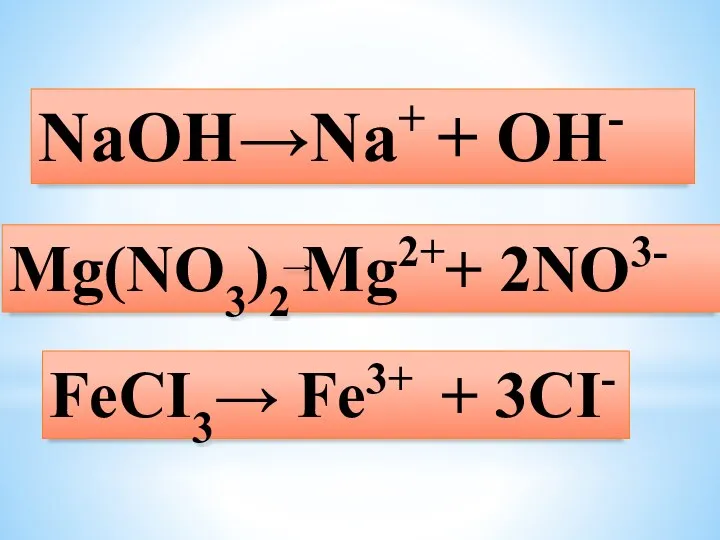
- 12. NaOH→Na+ + OH- FeCI3→ Fe3+ + 3CI- Mg(NO3)2 Mg2++ 2NO3-
- 13. NaCI→Na+ + CI- K2SO4 →2K+ + SO42- H2SO4 →2H+ + SO42-
- 14. Ca(OH)2→ Ca2+ + 2(OH)- AI(NO3)3 →AI3+ + 3(NO3)- CuCI2 → Cu2+ + 2CI-
- 15. Вещества слабые электролиты: CaCO3 BaSO4 Cu(OH)2 AgCI H2O Вещества неэлектролиты: CO2 SO3 О2
- 16. Cl- F- NO3- Na+ K+ Ag+ Li+ 1. ГРУППА №1 «ХИМИЧЕСКИЙ ДОЖДЬ» МЕЖДУ КАКИМИ ИОНАМИ ПРОИЗОЙДЕТ
- 17. Ag ++ CI- → AgCI-
- 18. ГРУППА №3 «ХИМИЧЕСКИЙ АКВАРИУМ» ВОЗМОЖНО ЛИ ОДНОВРЕМЕННОЕ ПРИСУТСТВИЕ В РАСТВОРЕ УКАЗАННЫХ ИОНОВ? Эпиграф к уроку –
- 19. 3Ag ++ PO43- → Ag3PO4
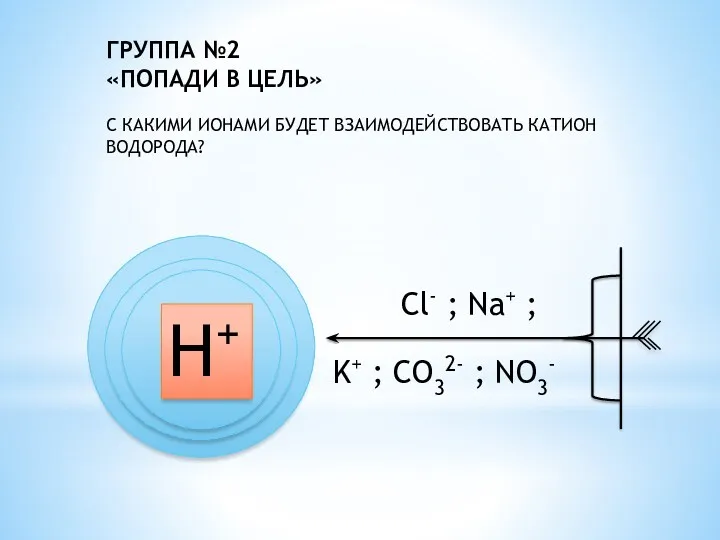
- 20. ГРУППА №2 «ПОПАДИ В ЦЕЛЬ» С КАКИМИ ИОНАМИ БУДЕТ ВЗАИМОДЕЙСТВОВАТЬ КАТИОН ВОДОРОДА? Н+ Cl- ; Na+
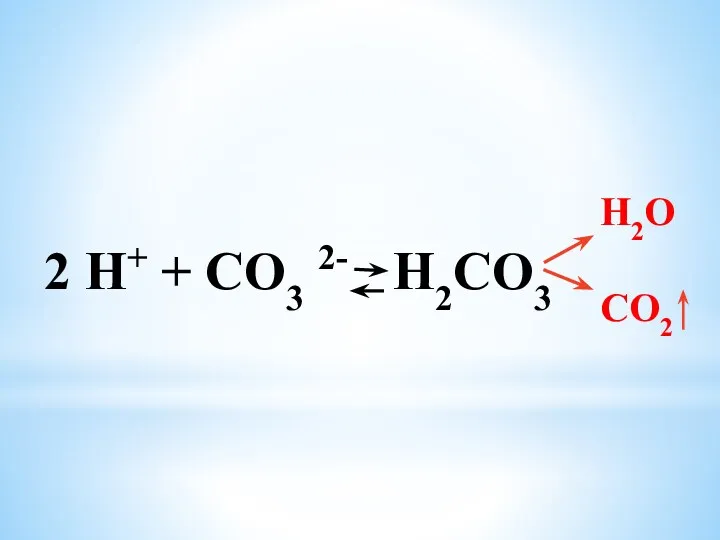
- 21. 2 H+ + CO3 2- H2CO3 H2O CO2
- 23. Тема урока: Реакции ионного обмена в растворах электролитов
- 24. Эпиграф к уроку – Электролитическая диссоциация оказалась применимой и полезной во всех областях современной науки Сванте
- 25. 1. K2CO3 + H2SO4 ? 2. Mg + HCI ? 3. Na2SO4 + Ba(NO3)2 ? 4.
- 26. Появление осадка; Выделение газа; Выделение (или поглощение) энергии; Изменение цвета; Появление запаха.
- 27. Инструктаж по технике безопасности: Запрещается использовать посуду, имеющую трещины и отбитые края.
- 28. Осторожно: кислоты и щёлочи – едкие вещества. Разрушают ткани, раздражают кожу, слизистые оболочки.
- 29. После завершения работы тщательно помыть руки с мылом под проточной водой.
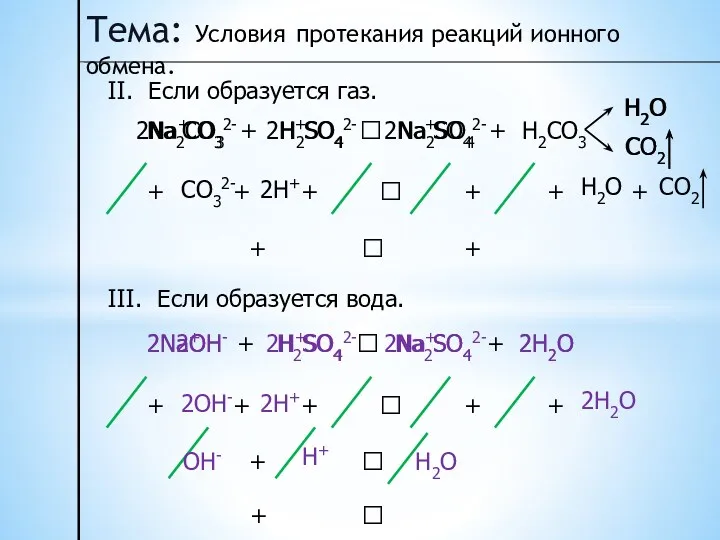
- 30. Тема: Условия протекания реакций ионного обмена. I. Если образуется осадок. BaCl2 + Na2SO4 ? BaSO4 +
- 31. Тема: Условия протекания реакций ионного обмена. II. Если образуется газ. Na2CO3 + H2SO4 ? Na2SO4 +
- 32. Выводы: 1. РИО – это реакции между растворами электролитов, при которых они обмениваются своими ионами. 2.
- 33. Значение реакций ионного обмена широко распространены в живой и неживой природе: - образование осадочных пород (гипс,
- 34. Задачи Задача 1. В сточных водах гальванического цеха химического завода обнаружены катионыFe3+, Ni2+ и анионы Cl-,
- 35. С какими веществами может реагировать фосфорная кислота, образуя а) газ; б) воду; в) осадок? Запишите уравнения
- 38. Скачать презентацию


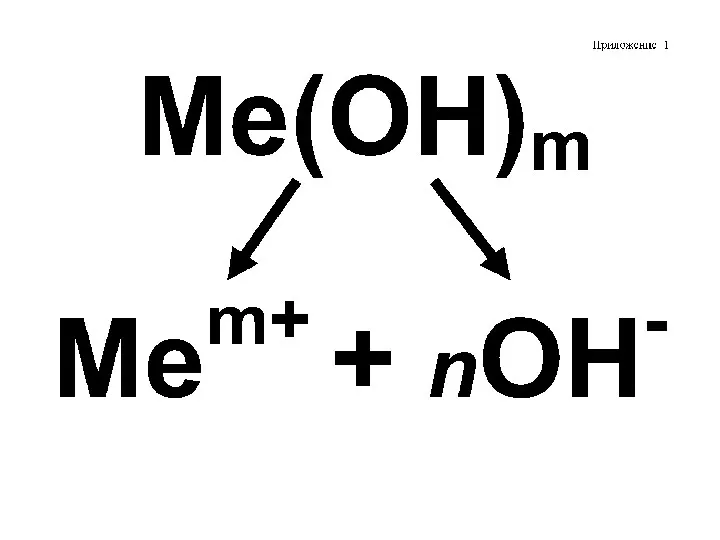


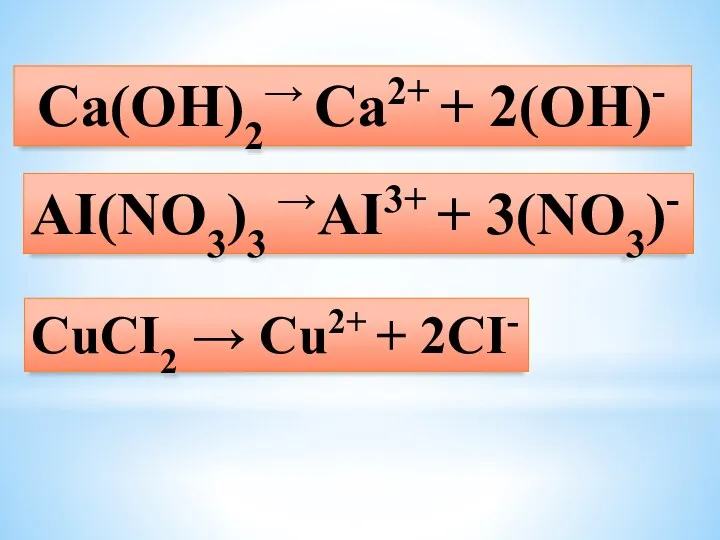


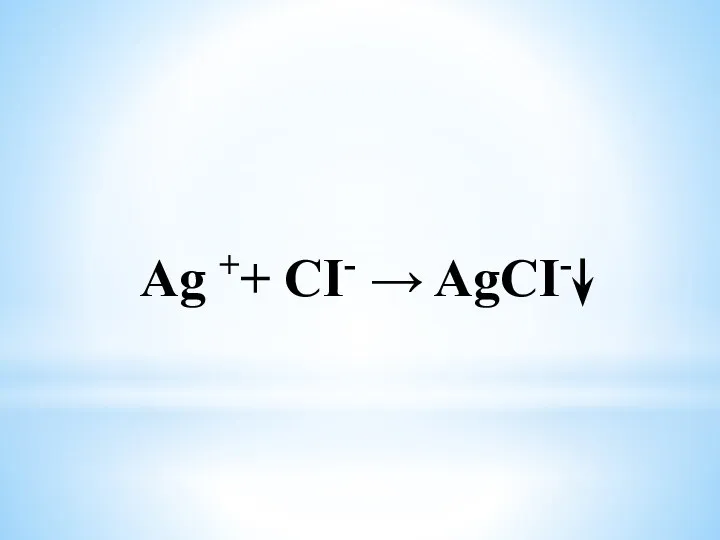

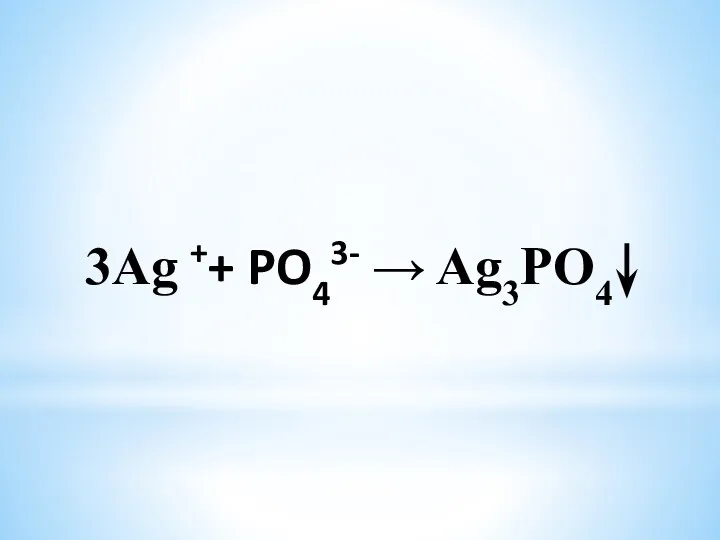


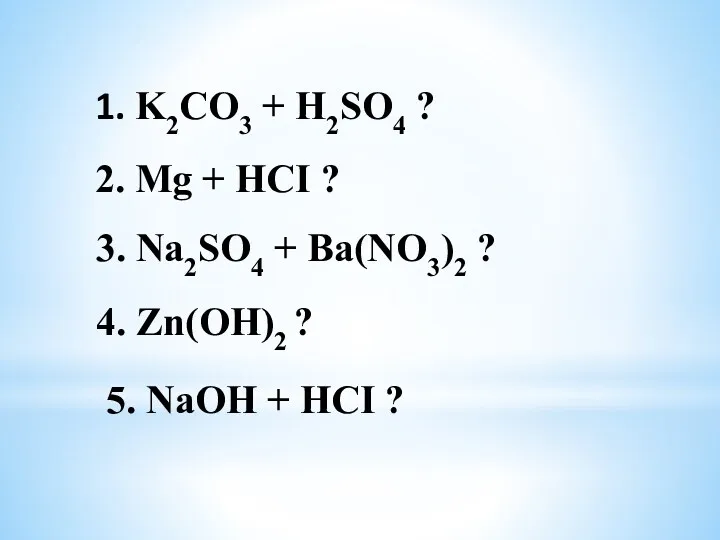










 Дослідження якісного складу солей. Практична робота №1
Дослідження якісного складу солей. Практична робота №1 Арены. Бензол. Урок химии. 10 класс
Арены. Бензол. Урок химии. 10 класс Зелёная химия
Зелёная химия Кислородсодержащие органические соединения. Спирты
Кислородсодержащие органические соединения. Спирты Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Свойства органических соединений
Свойства органических соединений Коллигативные свойства растворов
Коллигативные свойства растворов Драгоценные камни
Драгоценные камни Титриметрический анализ
Титриметрический анализ Минералды тыңайтқыштар өндірісі
Минералды тыңайтқыштар өндірісі Білки як високомолекулярні сполуки
Білки як високомолекулярні сполуки Аминокилоты. Свойства
Аминокилоты. Свойства Синтетические моющие средства
Синтетические моющие средства Закономерности химических реакций. (Лекция 3)
Закономерности химических реакций. (Лекция 3) Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды Адсорбция. Механизм адсорбции
Адсорбция. Механизм адсорбции Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Основные понятия и законы химии
Основные понятия и законы химии Оксиды. Классификация. Химические и физические свойства
Оксиды. Классификация. Химические и физические свойства Амины. Понятие об аминах. Анилин как органическое основание
Амины. Понятие об аминах. Анилин как органическое основание Кислородсодержащие соединения азота
Кислородсодержащие соединения азота Арены
Арены Липиды (Жиры)
Липиды (Жиры) Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства Ұшқыш уларды оқшаулауды теориялық негіздеу
Ұшқыш уларды оқшаулауды теориялық негіздеу Капиллярная конденсация
Капиллярная конденсация Количественное определение лекарственных веществ
Количественное определение лекарственных веществ