Содержание
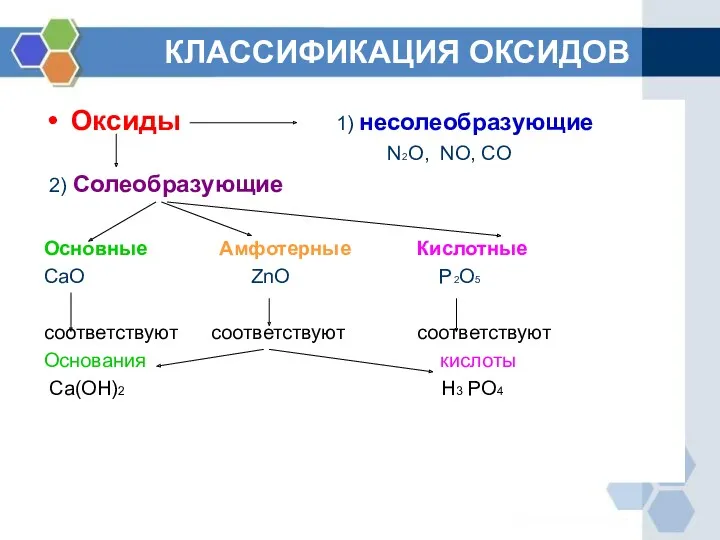
- 2. КЛАССИФИКАЦИЯ ОКСИДОВ Оксиды 1) несолеобразующие N2O, NO, CO 2) Солеобразующие Основные Амфотерные Кислотные CaO ZnO P2O5
- 3. ОПРЕДЕЛЕНИЕ ГРУПП ОКСИДОВ Основными называются оксиды, которые образуют соли при взаимодействии с кислотами или кислотными оксидами.
- 4. НАПМИСАТЬ ХИМИЧЕСКИЕ ФОРМУЛЫ ОКСИДОВ 1)Оксид серы(IV) 2)Оксид азота(V) 3)Оксид калия (I) 4)Оксид железа(II) 5)Оксид фосфора(V) 6)
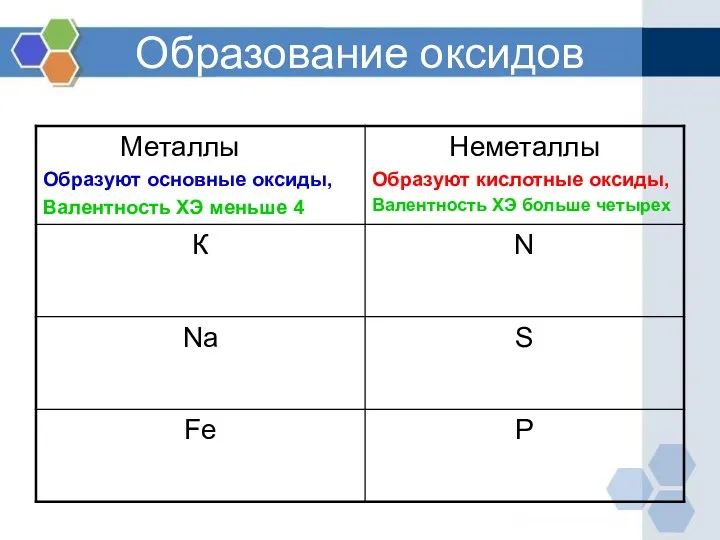
- 5. Образование оксидов
- 6. ФОРМУЛЫ ОКСИДОВ 1)Оксид серы(IV) 2)Оксид азота(V) 3)Оксид калия (I)- основной оксид 4)Оксид железа(II) – основной оксид
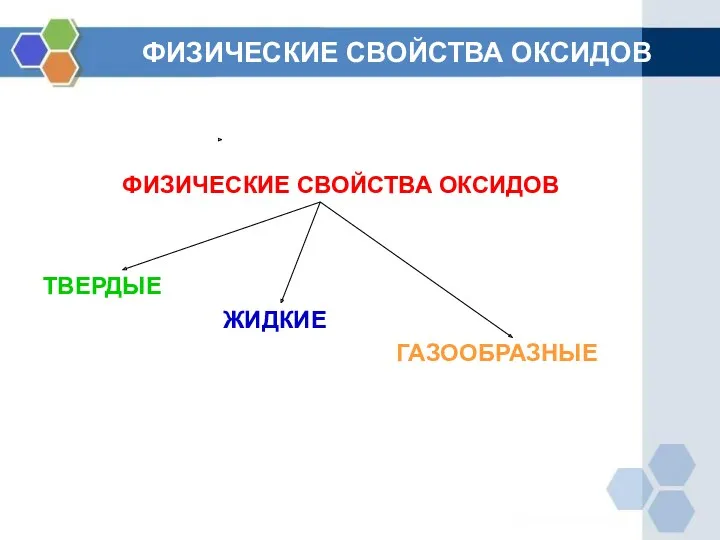
- 7. ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ ФИЗИЧЕСКИЕ СВОЙСТВА ОКСИДОВ ТВЕРДЫЕ ЖИДКИЕ ГАЗООБРАЗНЫЕ
- 8. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ (О.О.) 1) О.О. + кислота =соль + вода (реакция обмена) CaO +
- 9. Химические свойства кислотных оксидов (К.О.) 1) К.О. + основание = соль + вода (реакция обмена) SO3
- 10. Амфотерные оксиды 1) с кислотами как основные ZnO + 2HCl = ZnCl2 + H2O 2) с
- 12. Скачать презентацию






 Минералогия литофильных редких элементов. Цезий и рубидий
Минералогия литофильных редких элементов. Цезий и рубидий Главная подгруппа VIII группы периодической системы. Девятнадцатая лекция
Главная подгруппа VIII группы периодической системы. Девятнадцатая лекция d-элементы
d-элементы Изучение раздела Углеводороды в курсе органической химии в старшей школе
Изучение раздела Углеводороды в курсе органической химии в старшей школе Понятие об алкинах
Понятие об алкинах Азотная кислота и нитраты
Азотная кислота и нитраты Brass
Brass Никель қаптамаларын алу жолдары
Никель қаптамаларын алу жолдары Первая группа периодической системы Менделеева. Щелочные металлы
Первая группа периодической системы Менделеева. Щелочные металлы Маркировка пластиковой посуды
Маркировка пластиковой посуды Номенклатура органических веществ
Номенклатура органических веществ Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Обобщающий урок по теме Металлы
Обобщающий урок по теме Металлы Галогены
Галогены Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Растворы электролитов
Растворы электролитов Бытовая химия
Бытовая химия Полимеры. Каучук
Полимеры. Каучук Металлы. Свойства металлов
Металлы. Свойства металлов Кислород
Кислород Горение топлива
Горение топлива Химия и искусство
Химия и искусство 20230419_oksidy
20230419_oksidy Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома
Железо. Характеристика химического элемента железа по его положению в ПСХЭ и строению атома Металлы в природе. Общие способы их получения
Металлы в природе. Общие способы их получения Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3)
Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3) Аллотропия. Аллотропные модификации
Аллотропия. Аллотропные модификации Получение и химические свойства оснований
Получение и химические свойства оснований