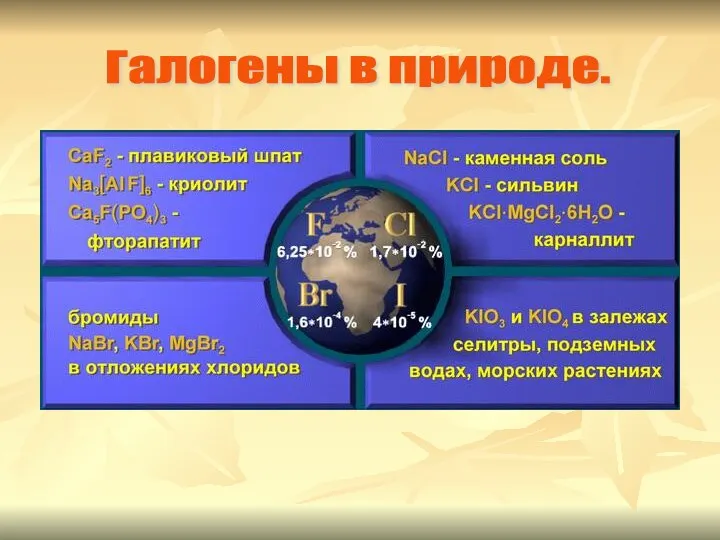
Открытие галогенов.
Фтор в свободном виде получил впервые в 1866 г. Французский
химик Анри Муассан, который был удостоен Нобелевской премии. Свое название элемент получил от греч. фторос – разрушающий.
Хлор открыт химиком К. Шееле в 1774 г. Элемент получил название за свой цвет ( от греч. хлорос – желто - зеленый).
Бром открыт в 1826 г. Французским химиком А. Баларом. Элемент назван так за свой запах (греч. бромос – зловонный).
Йод получен в 1811 г. французским ученым Б. Куртуа, а название получил за цвет своих паров (греч. иодэс – фиолетовый).




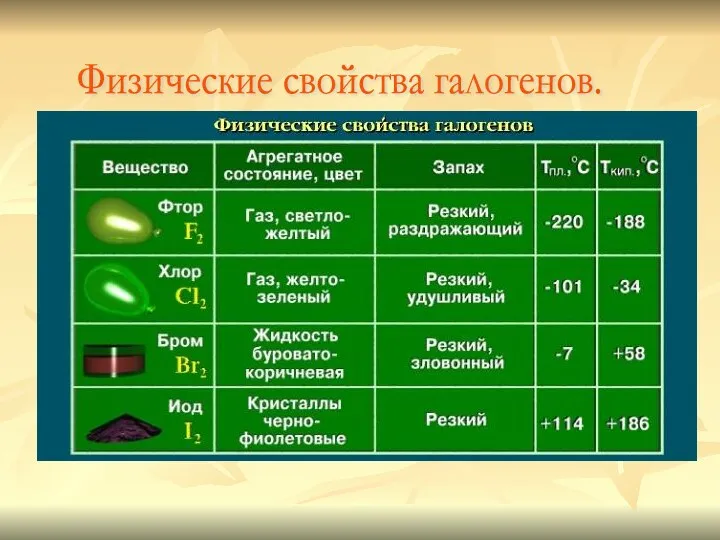




 Окислительно-восстановительные реакции. 11 класс
Окислительно-восстановительные реакции. 11 класс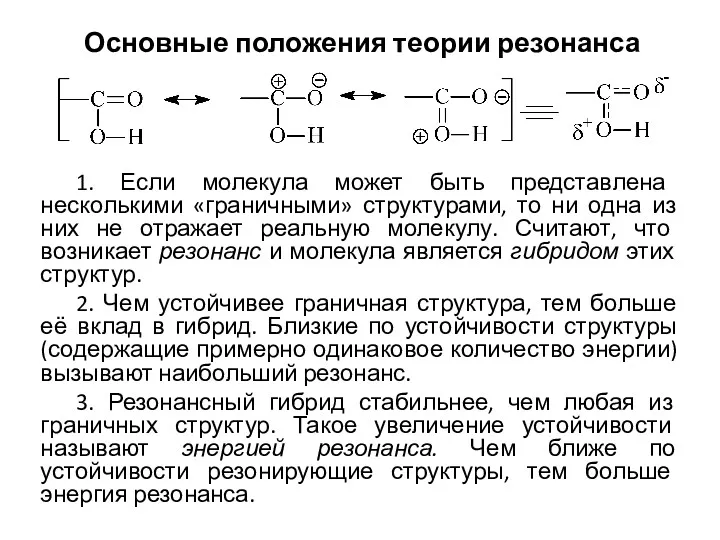 Основные положения теории резонанса
Основные положения теории резонанса Сера и ее соединения
Сера и ее соединения Массовая доля химического элемента
Массовая доля химического элемента Вяжущие вещества
Вяжущие вещества Химическая промышленность России
Химическая промышленность России Гідроліз солей
Гідроліз солей Целевой и содержательный компоненты процесса обучения химии
Целевой и содержательный компоненты процесса обучения химии Химическая термодинамика. Термохимия
Химическая термодинамика. Термохимия Химический элемент кремний
Химический элемент кремний Полимеры, бумага
Полимеры, бумага Количество вещества. Моль
Количество вещества. Моль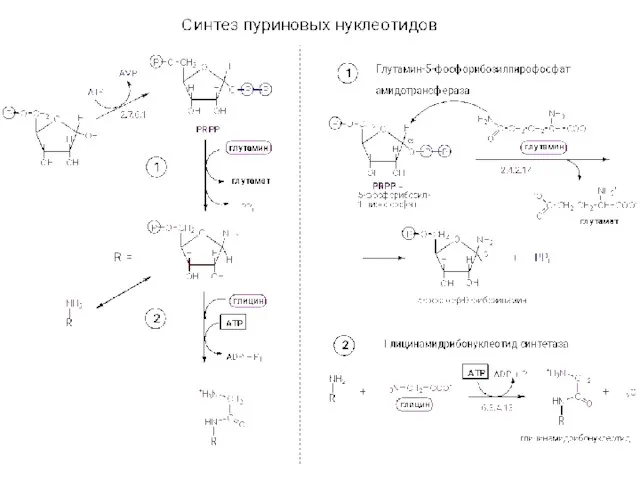 Синтез нуклеотидов
Синтез нуклеотидов Практическая работа №1. Приготовление раствора с определенной массовой долей соли
Практическая работа №1. Приготовление раствора с определенной массовой долей соли Целлюлоза
Целлюлоза Алкины. Ацетилены
Алкины. Ацетилены Введение в химическую термодинамику
Введение в химическую термодинамику Biomass Feedstocks
Biomass Feedstocks Коллигативные свойства растворов
Коллигативные свойства растворов Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ
Химические свойства простых металлов, неметаллов и оксидов. Задание 6 по ЕГЭ Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве
Смолы и бальзамы. Воски и структурообразующие вещества в косметическом производстве Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ
Процессы и технологическая схема производства сегодня. АО Газпромнефть-ОНПЗ Презентация по химии _Классификация веществ_ 11 класс
Презентация по химии _Классификация веществ_ 11 класс Тренинг. Практическая химия (8-9 классы)
Тренинг. Практическая химия (8-9 классы) Лекция 7. Кислотно-основное равновесие в растворах
Лекция 7. Кислотно-основное равновесие в растворах Алканы. Гомологи
Алканы. Гомологи Контроль качества пищевых товаров
Контроль качества пищевых товаров Электрохимические процессы
Электрохимические процессы