Содержание
- 3. Гомологи- соединения, принадлежащие к одному классу, но отличающиеся друг от друга по составу на целое число
- 5. Изомерия- явление, заключающееся в существовании химических соединений (изомеров), одинаковых по составу и молекулярной массе, но различающихся
- 6. Изомеры – это вещества с одинаковой молекулярной формулой, но разным химическим строением. Химическое строение- это порядок
- 8. Для алканов с открытой цепью характерен только один вид изомерии – структурный. Изомеры с одинаковым числом
- 12. Правила составления названий. 1. Выбрать в структурной цепи наиболее длинную цепь атомов углерода. Если какие-то фрагменты
- 13. 2. Пронумеровать атомы углерода в выбранной цепи с того конца, к которому ближе находится разветвление. Если
- 14. 3. Дать название радикалу – боковому разветвлению. Причем перед ним ставят номер того атома в углеродной
- 15. 4. Если замещающих разветвлений несколько, то цифрой отмечают каждое из них, перечисляя радикалы в алфавитном порядке
- 16. 5. Если в формуле встречаются одинаковые радикалы, то сначала через запятые перечисляют цифрами местоположения разветвлений, затем
- 17. 6. Если у одного и того же атома углерода находится два одинаковых радикала, то цифру повторяют
- 18. 7. К названию последнего радикала добавляют название того алкана, который содержит такое же количество атомов углерода,
- 19. 8. При выборе главной цепи в случае большого количества разветвлений направление нумерации указывают так, чтобы цифры,
- 20. Изомеры гексана С6Н14 н-гексан 2-метилпентан 3-метилпентан 2,3-диметилбутан 2,2-диметилбутан
- 21. Примеры изображений структурных формул.
- 22. Рациональная (заместительная) номенклатура По рациональной номенклатуре углеводороды рассматриваются как производные метана, у которого один или несколько
- 24. Чем сложнее формула вещества, тем труднее (а иногда и невозможно) его назвать по рациональной номенклатуре. Поэтому
- 25. Дать названия веществам:
- 26. Физические свойства алканов.
- 27. Физические свойства алканов
- 29. Нахождение алканов в природе. Основные источники алканов – нефть и природный газ. Метан составляет основную массу
- 30. Простейший представитель предельных углеводородов — метан — образуется в природе в результате разложения остатков растительных и
- 31. Метан составляет основную массу природного газа (80 -97%). Он содержится и в газах, выделяющихся при добыче
- 33. Твердые алканы встречаются в природе в виде залежей горного воска – озокерита, в восковых покрытиях листьев,
- 39. Химические свойства алканов. Для алканов характерны реакции: I.Замещения. II.Крекинг. III.Дегидрирование. IV.Изомеризация. V.Окисление.
- 41. I.Реакции замещения. 1.Галогенирование алканов – реакция замещения одного или более атомов водорода в молекуле алкана на
- 42. Механизм реакции замещения. 1 стадия – зарождение цепи - появление в зоне реакции свободных радикалов. Под
- 43. 2 стадия – рост (развитие) цепи. Свободные радикалы, взаимодействуя с молекулами, порождают новые радикалы и развивают
- 44. 3 стадия – обрыв цепи. Радикалы, соединяясь друг с другом, образуют молекулы и обрывают цепь превращений:
- 45. Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е. как цепь последовательных превращений с участием свободно-радикальных
- 46. СЕМЁНОВ Николай Николаевич 15 апреля 1896 г. – 25 сентября 1986 г. Лауреат Нобелевской премии по
- 47. Постадийное хлорирование метана:
- 48. Замещение у хлорметана идет легче, чем у метана, так как атом хлора поляризует связи С-Н и
- 49. Легче замещается атом водорода: С трет. > С втор. > Cперв. При хлорировании или бромировании алкана
- 51. При нитровании алканов также соблюдается порядок реакционной способности С-Н-связей, характерный для реакций радикального замещения: С тр.>С
- 52. 3.Сульфирование.
- 53. II.Дегидрирование-отщепление водорода. 1. Реакция идет при повышенной температуре и в присутствии катализатора. 2.Образуются: -алкены -алкины -алкадиены
- 54. Ароматизация алканов приводит к образованию ароматических УВ. Катализатор Сr2О3 и высокая температура:
- 55. III.Крекинг- разрыв связи С-С Образуются два продукта: алкан и алкен-1: -крекинг идет (как правило) посередине; крекингу
- 56. IV.Изомеризация- перестройка углеродной цепи. Образуются изомеры- вещества с одинаковой МФ, но разным химическим строением. Катализатор- АlCl3
- 58. V.Реакции окисления. 1.Горение алканов:
- 59. метиловый спирт: 2СН4 + О2 → 2СН3ОН; формальдегид: СН4 + О2 → СН2О + Н2O; муравьиная
- 60. Особые свойства метана. Конверсия метана- нагревание с водяным паром: Пиролиз метана-нагревание метана при высокой при 1500
- 61. СПОСОБЫ ПОЛУЧЕНИЯ МЕТАНА И ЕГО ГОМОЛОГОВ. Способы получения
- 62. Получение метана 1.Гидролиз карбида алюминия: Аl4C3+12НОН→4Al(ОН)3 + 3СН4 Кислотный гидролиз: Аl4C3+12НCl→4AlCl3 + 3СН4 Аl4C3+12НNО3→4Al(NО3)3 + 3СН4
- 63. 2.Сплавление ацетата натрия (калия) со щелочью: CH3COONa + NaOH→ CH4↑ + Na2CO3 3. Синтез на основе
- 64. Получение гомологов метана. 1.Реакция Вюрца- взаимодействие галогеналканов с металлическим натрием. Реакция необходима для удлинения цепи. 2.Реакция
- 65. Реакция Вюрца. Взаимодействие галогеналканов с металлическим натрием. При взаимодействии галогеналканов с металлическим натрием получаются алканы с
- 66. Взаимодействие двух одинаковых галогеналкана приводит к образованию одного нового алкана. Если взять два разных галогеналкана, то
- 67. Декарбоксилирование При сплавлении безводных солей карбоновых кислот со щелочами получаются алканы, содержащие на один атом углерода
- 68. Метод Фишера-Тропша. Взаимодействие оксида углерода и водорода (синтез-газ) в присутствии катализатора (кобальта или никеля):
- 69. Гидрирование алкенов, алкинов, алкадиенов. При взаимодействии алкенов с водородом (реакция гидрирования) в присутствии металлических катализаторов (никель,
- 70. Реакция Кольбе. Электролиз солей щелочных металлов и карбоновых кислот
- 74. Скачать презентацию
 Роль жиров в организме человека
Роль жиров в организме человека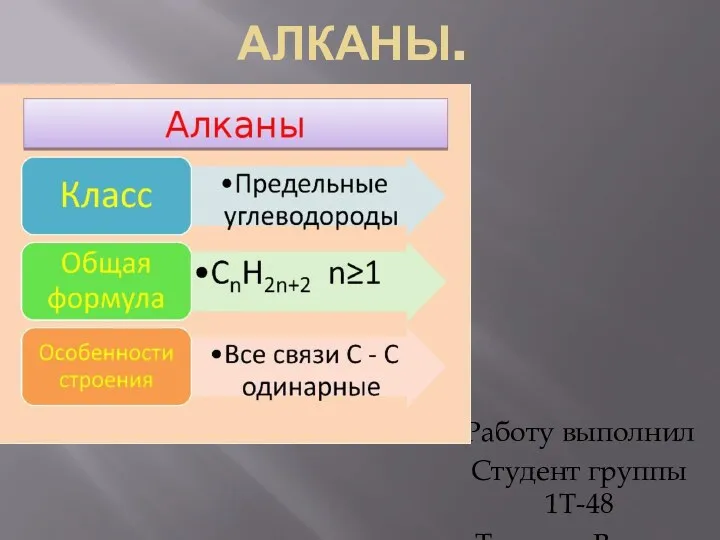 Алканы. Гомологический ряд и изомерия
Алканы. Гомологический ряд и изомерия ОВР в органической химии
ОВР в органической химии Розрахунки за хімічними рівняннями
Розрахунки за хімічними рівняннями Хімічна рівновага. Принцип зміщення хімічної рівноваги
Хімічна рівновага. Принцип зміщення хімічної рівноваги Химический калейдоскоп. Слайд-газета
Химический калейдоскоп. Слайд-газета Магматические и метаморфические горные породы. (Лекция 7)
Магматические и метаморфические горные породы. (Лекция 7) Алкины. 10 класс
Алкины. 10 класс Алкены
Алкены Процессы нитрозирования и основные реакции диазосоединений
Процессы нитрозирования и основные реакции диазосоединений Материаловедение и технологии конструкционных материалов
Материаловедение и технологии конструкционных материалов Химическая посуда и её назначение (9)
Химическая посуда и её назначение (9) Минеральные удобрения. Для школьников
Минеральные удобрения. Для школьников Этапы гравиметрического анализа. (Лекция 3)
Этапы гравиметрического анализа. (Лекция 3) Химическая промышленность
Химическая промышленность Сера и ее соединения
Сера и ее соединения Типы химических реакций
Типы химических реакций Химия и путешествия во времени. Задача 7
Химия и путешествия во времени. Задача 7 Електроннокаталітична переробка діоксиду вуглецю в формальдегід та метанол при атмосферному тиску
Електроннокаталітична переробка діоксиду вуглецю в формальдегід та метанол при атмосферному тиску Простые вещества
Простые вещества Вещества и физические тела
Вещества и физические тела Механическая смесь и растворы
Механическая смесь и растворы Коллоидная химия
Коллоидная химия Свойства воды
Свойства воды Геохимия стабильных изотопов, Радиоуглеродный метод
Геохимия стабильных изотопов, Радиоуглеродный метод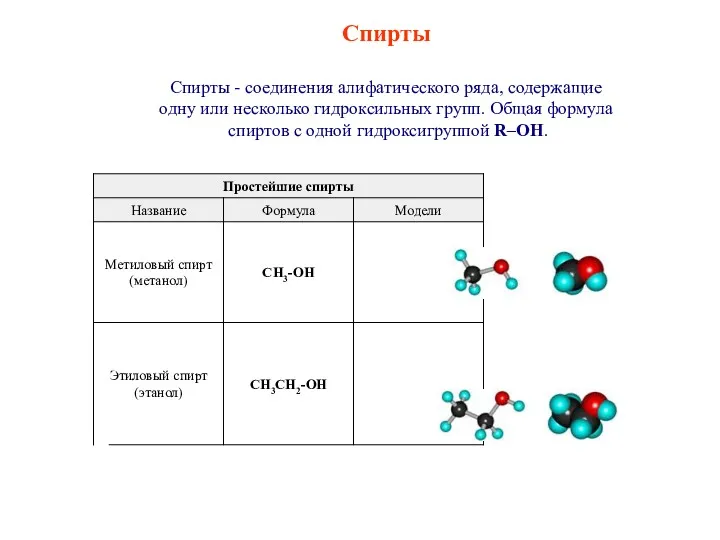 Спирты. Классификация спиртов
Спирты. Классификация спиртов Қышқылдар мен сілтілер тепе-теңдігі
Қышқылдар мен сілтілер тепе-теңдігі Оксиды. Бинарное соединение. Степень окисления у неметаллов
Оксиды. Бинарное соединение. Степень окисления у неметаллов