Содержание
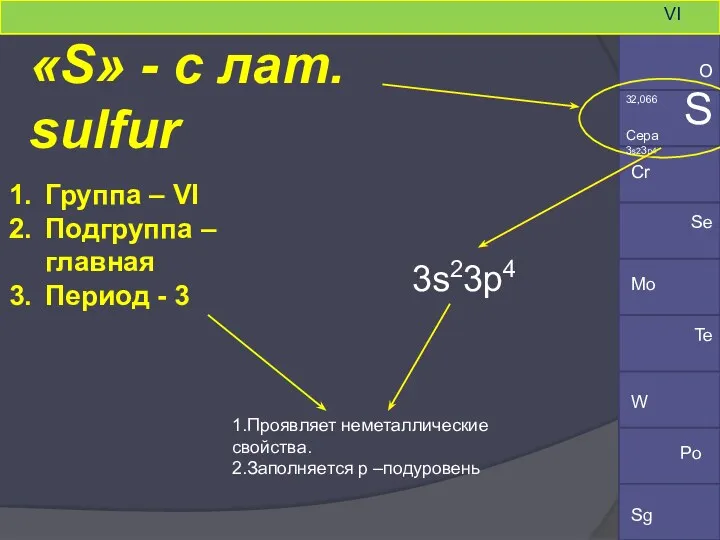
- 2. «S» - c лат. sulfur Группа – VI Подгруппа – главная Период - 3 Cr Mo
- 3. Применение: Самородная сера Сульфат серы: FeS2 (пирит или железный колчедан), CuS(медный блеск), CuFeS2 (халькопирит или медный
- 4. Получение серы: Вулканическая сера образуется по реакции: 2Н2S +SO2 =3S + 2S2O
- 6. Свойства серы: 1.Сера является окислителем по отношению в первую очередь к металлам: Fe + S =
- 7. Свойства серы: 2. Сера является более слабым окислителем, чем кислород, но взаимодействует с металлами гораздо активнее.
- 8. Свойства серы: 3. Восстановительные свойства сера проявляет в реакциях с простыми веществами, образованными неметаллами с большими
- 9. Свойства серы: 4. Сера будет восстановителем и по отношению к сложным веществам-окислителям: S + 2H2SO4 (конц.)->
- 10. Наиболее известные положительные значения степени окисления сера +2, +4, +6, что объясняется различными электронными конфигурациями атомов
- 11. Сера способна присоединяться по кратным связям олефиновых углеродов, «сшивая» при это молекулы своеобразным дисульфидным мостиков –S-S-.
- 12. Применение: - для производства серной кислоты -сульфитов - борьбы с болезнями растений - производство красителей -
- 13. Сероводород: Содержится в вулканических газах и постоянно образуется на дне Черного моря. Образуется при гниение белков,
- 14. Получение: FeS + 2HCl = FeCl2 + H2S
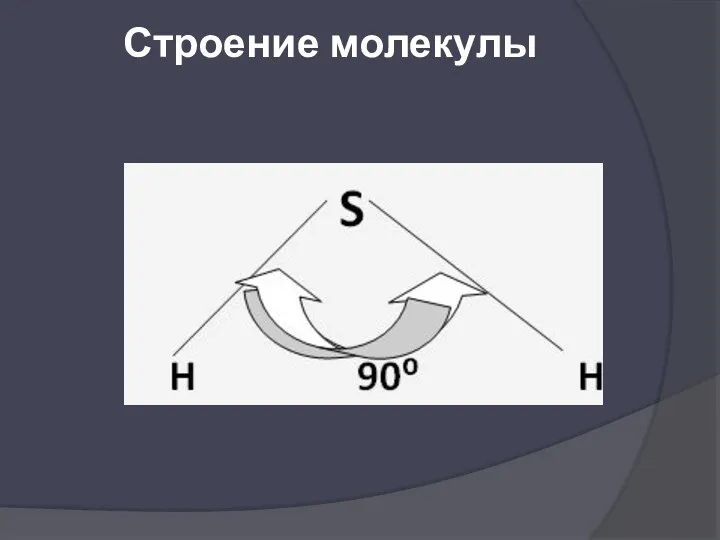
- 15. Строение молекулы
- 16. Свойства сероводорода: Сероводород сильный восстановитель. Он легко сгорает в кислороде или на воздухе: 2Н2S + O2
- 17. Свойства сероводорода: Легко окисляется галогенами, оксидом серы (VI), хлоридом железа (III): Н2S + Cl2 = 2HCl
- 18. Сероводородная кислота и сульфиды Сероводород хорошо растворим в спирте хуже – воде (при комнатной температуре только
- 19. Как двухосновная кислота сероводородная кислота образует ряд солей – средние (сульфиды) и кислые (гидросульфиды): 2KOH +
- 20. PbS ZnS
- 21. Как и оксиды, сульфиды в зависимости от степени окисления второго элемента могут быть основными (Na2S, K2S),
- 22. Как и сероводород, сероводородная кислота и сульфиды являются сильными восстановителями: H2S + 2HNO3 (конц.) = S+
- 23. Оксид серы (IV) Получение: Происходит реакция обмена между сульфитом и раствором серной кислоты: Na2SO3 + H2SO4
- 24. Оксид серы (IV) - бесцветный газ с резким запахом, менее токсичен, чем сероводород, но луче растворим
- 25. При растворении в воде образуется гидраты сернистого газа, формулы которых записывают в виде молекулы сернистой кислоты:
- 26. В водном растворе серистого газа, часто называемого сернистой кислотой (такая кислота не существует в свободном виде),
- 27. В воде растворимы сульфиты щелочных металлов и гидросульфиты. Растворы средних солей хорошо гидролизируются по аниону: Na2SO3
- 28. Свойства: 1.Окислительные свойства Оксид серы (IV): SO2 + 2H2S = 3S + 2H2O 2. Восстановительные свойства
- 29. Применение: Сернистый газ применяют в производстве серной кислоты, Оксид серы (IV), сульфидов, гидросульфидов, шелка, соломы, консервирования
- 30. Получение: Оксид серы (VI)(серный ангидрид) получают как промежуточный продукт при производстве серной кислоты каталитическим окислением сернистого
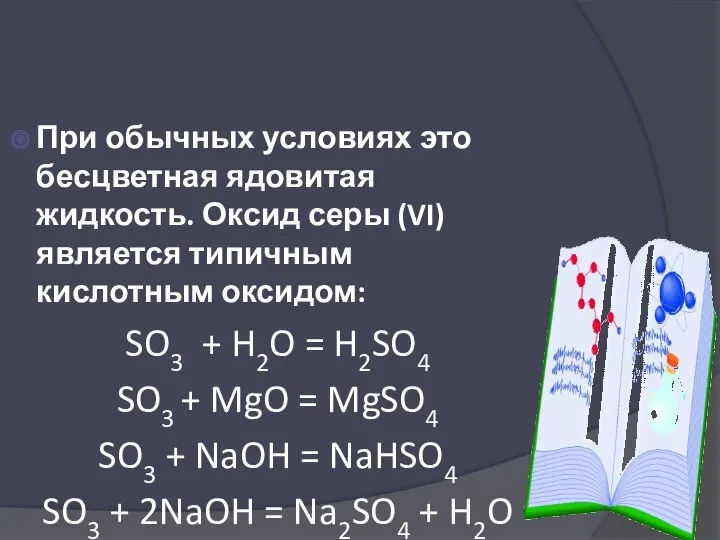
- 31. При обычных условиях это бесцветная ядовитая жидкость. Оксид серы (VI) является типичным кислотным оксидом: SO3 +
- 32. Серная кислота и её соли Получение: 1 стадия Получение SO2. Из колчедана путем методом кипящего слоя
- 33. Свойства: Химические свойства серной кислоты в значительной степени зависят от ее концентрации!!!!
- 34. Разбавленная серная кислота: Проявляет все свойства кислот: взаимодействует с металлами, оксидами металлов, основаниями и солями Образует
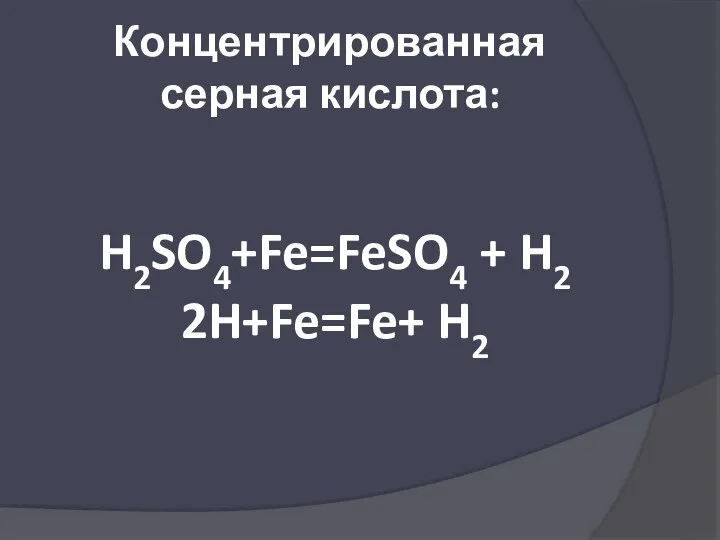
- 35. Концентрированная серная кислота: H2SO4+Fe=FeSO4 + H2 2H+Fe=Fe+ H2
- 36. Концентрированная серная кислота: Концентрированная серная кислота окисляет металлы вне зависимости от их места их положения, НО
- 37. Концентрированная серная кислота: Железо, алюминий, хром концентрированная серная кислота пассивирует 2Fe + 6H2SO4 = Fe2(SO4)3+3SO2+6H2O
- 38. Концентрированная серная кислота: Наиболее активные из металлов - щелочные, щелочно-земельные, магний и цинк - восстанавливают сульфат
- 39. Концентрированная серная кислота: Окислителем кислота выступает и по отношению к неметаллами 2P+5H2SO4=2H3PO4+5SO2+2H2O C+ H2SO4=2SO2+CO2+2H2O
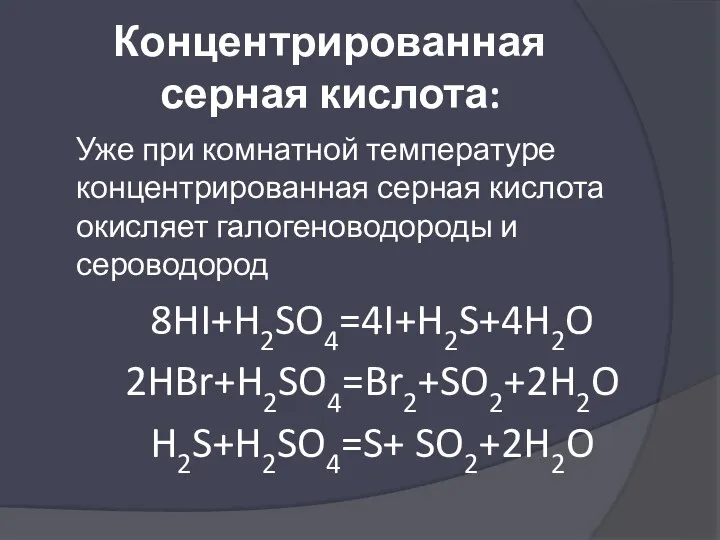
- 40. Концентрированная серная кислота: Уже при комнатной температуре концентрированная серная кислота окисляет галогеноводороды и сероводород 8HI+H2SO4=4I+H2S+4H2O 2HBr+H2SO4=Br2+SO2+2H2O
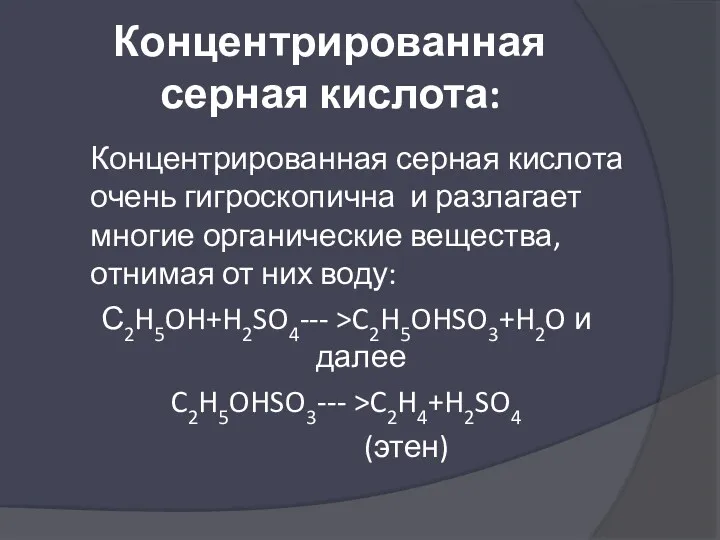
- 41. Концентрированная серная кислота: Концентрированная серная кислота очень гигроскопична и разлагает многие органические вещества, отнимая от них
- 42. Серная кислота образует сложные эфиры с высшими спиртами. Эта реакция лежит в основе получения синтетических моющих
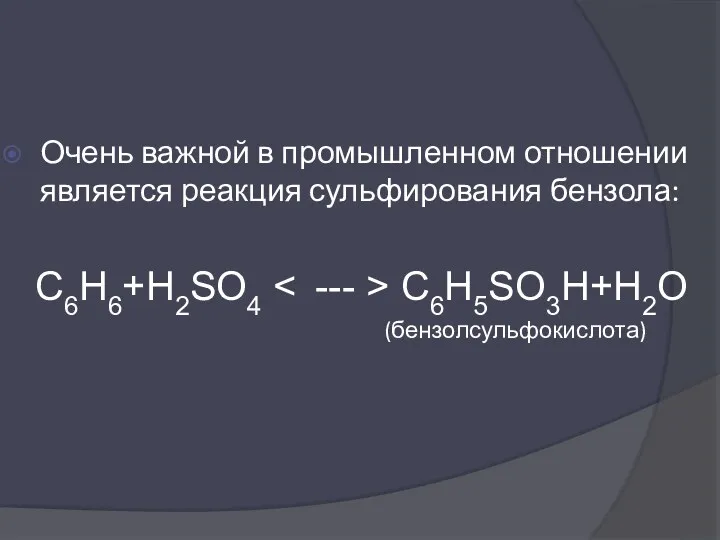
- 43. Очень важной в промышленном отношении является реакция сульфирования бензола: C6H6+H2SO4 C6H5SO3H+H2O (бензолсульфокислота)
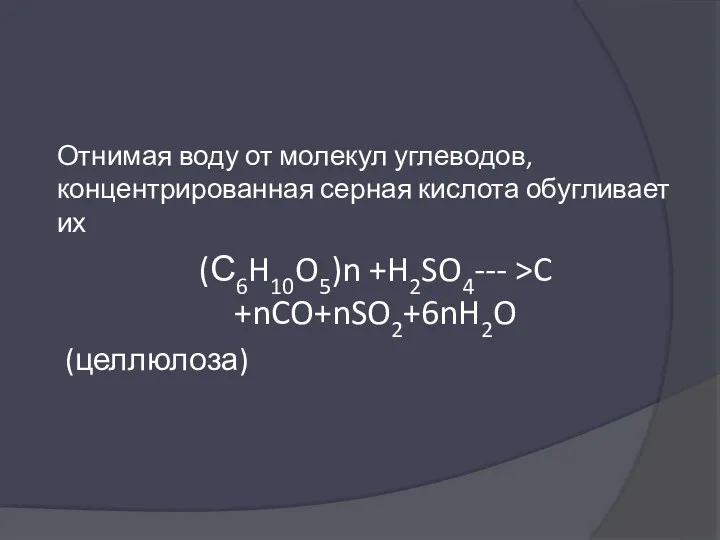
- 44. Отнимая воду от молекул углеводов, концентрированная серная кислота обугливает их (С6H10O5)n +H2SO4--- >C +nCO+nSO2+6nH2O (целлюлоза)
- 45. Применение: Серную кислоту широко используют в производстве: Удобрений Синтетических моющих средств Минеральных кислоты, солей Для получения:
- 47. Скачать презентацию




































 Моделирование структуры биомакромолекул
Моделирование структуры биомакромолекул Особенности дисперсных систем
Особенности дисперсных систем Inert metals
Inert metals Урок 19. Практична робота №1. Реакції йонного обміну між електролітами у водних розчинах
Урок 19. Практична робота №1. Реакції йонного обміну між електролітами у водних розчинах Циклоалкандар
Циклоалкандар Полімери. Природні полімери
Полімери. Природні полімери Своя игра по химии
Своя игра по химии Алкилсульфонаттарды алу және технологиялық сызбанұсқасы
Алкилсульфонаттарды алу және технологиялық сызбанұсқасы Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи
Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Введение в органическую химию
Введение в органическую химию Хімія та їжа
Хімія та їжа История становления органической химии
История становления органической химии Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Plastics слайды
Plastics слайды Ртуть. Использование ртути
Ртуть. Использование ртути Газовые гидраты
Газовые гидраты Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп Чипсы: вред или польза
Чипсы: вред или польза Химический элемент хлор
Химический элемент хлор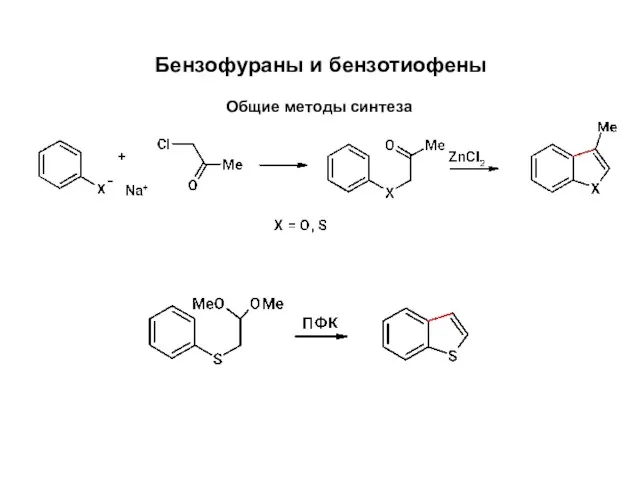 Бензофураны и бензотиофены. Общие методы синтеза
Бензофураны и бензотиофены. Общие методы синтеза Понятие о солях (8 класс)
Понятие о солях (8 класс) Фармацевтическая химия натрия гидрокарбоната
Фармацевтическая химия натрия гидрокарбоната Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн
Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн Электрохимический ряд напряжений металлов. Свойства металлов
Электрохимический ряд напряжений металлов. Свойства металлов Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов