Содержание
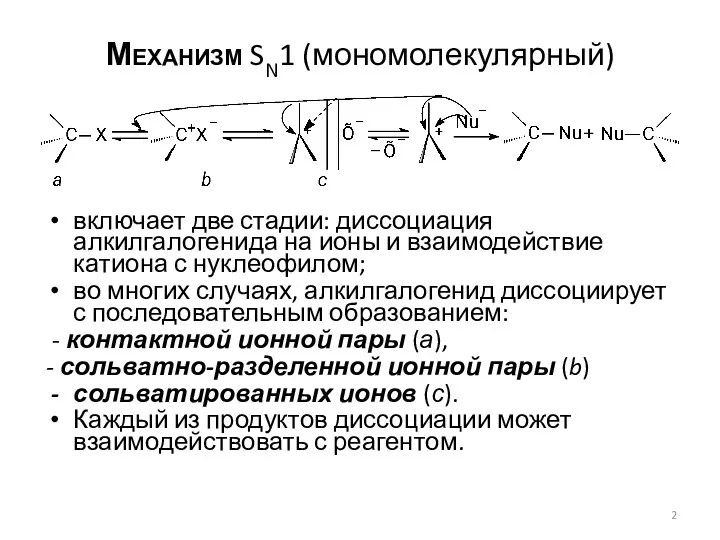
- 2. Механизм SN1 (мономолекулярный) включает две стадии: диссоциация алкилгалогенида на ионы и взаимодействие катиона с нуклеофилом; во
- 3. Стереоизомерия SN1 - реакций Нуклеофильная атака ионной пары (а) приводит к обращению конфигурации (асимметрия углерода в
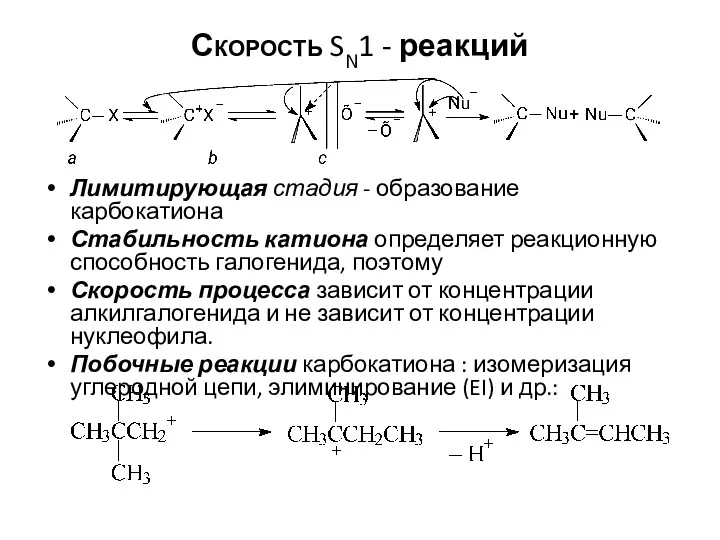
- 4. Скорость SN1 - реакций Лимитирующая стадия - образование карбокатиона Стабильность катиона определяет реакционную способность галогенида, поэтому
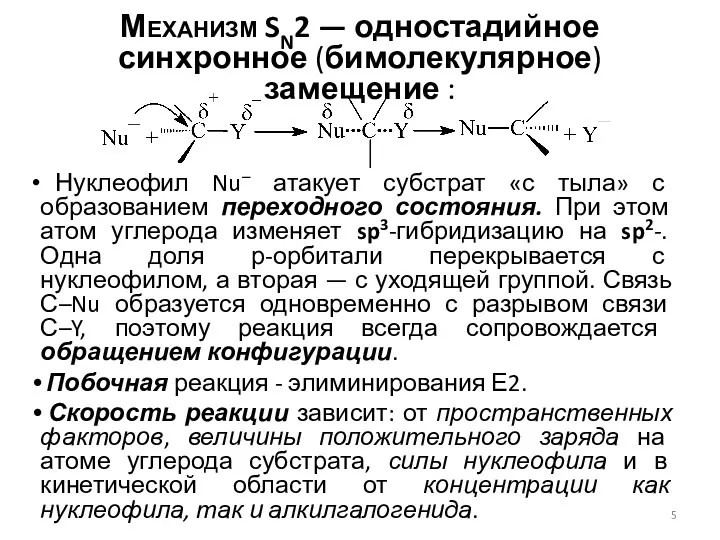
- 5. Механизм SN2 — одностадийное синхронное (бимолекулярное) замещение : Нуклеофил Nu– атакует субстрат «с тыла» с образованием
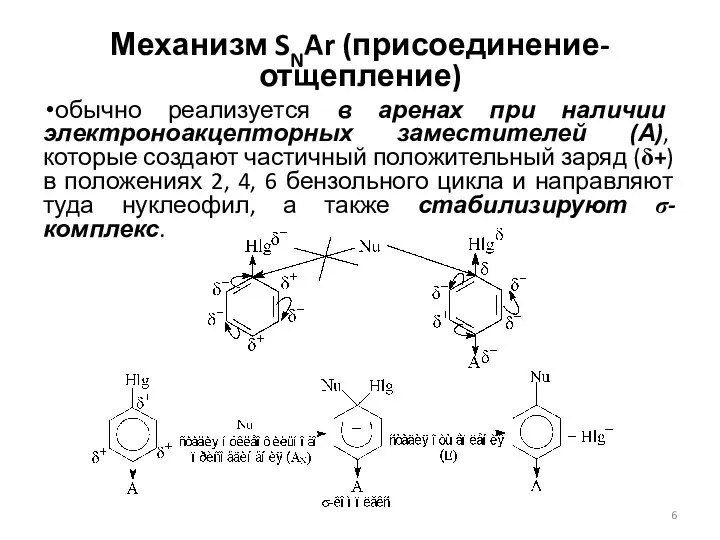
- 6. Механизм SNAr (присоединение-отщепление) обычно реализуется в аренах при наличии электроноакцепторных заместителей (А), которые создают частичный положительный
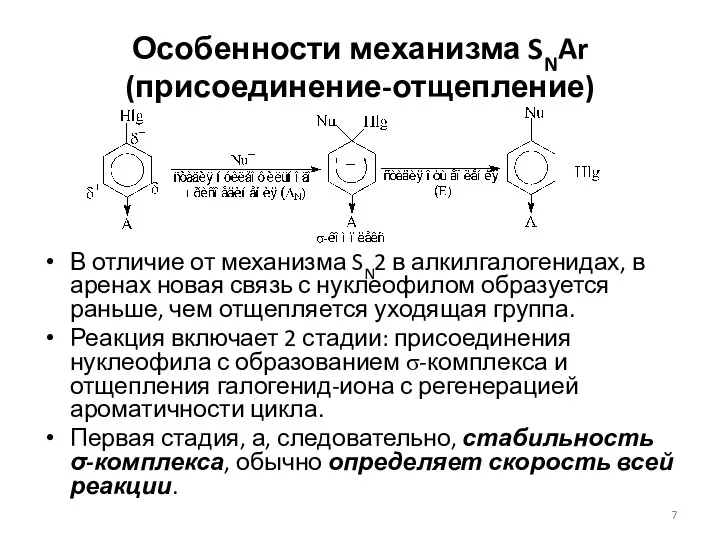
- 7. Особенности механизма SNAr (присоединение-отщепление) В отличие от механизма SN2 в алкилгалогенидах, в аренах новая связь с
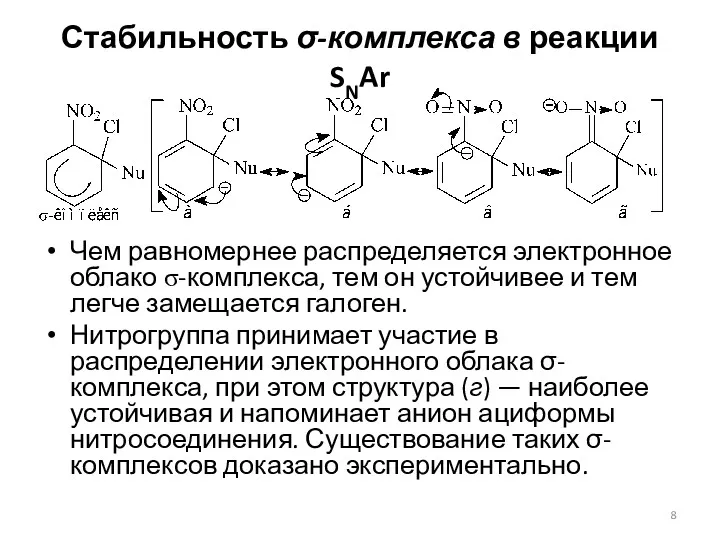
- 8. Стабильность σ-комплекса в реакции SNAr Чем равномернее распределяется электронное облако σ-комплекса, тем он устойчивее и тем
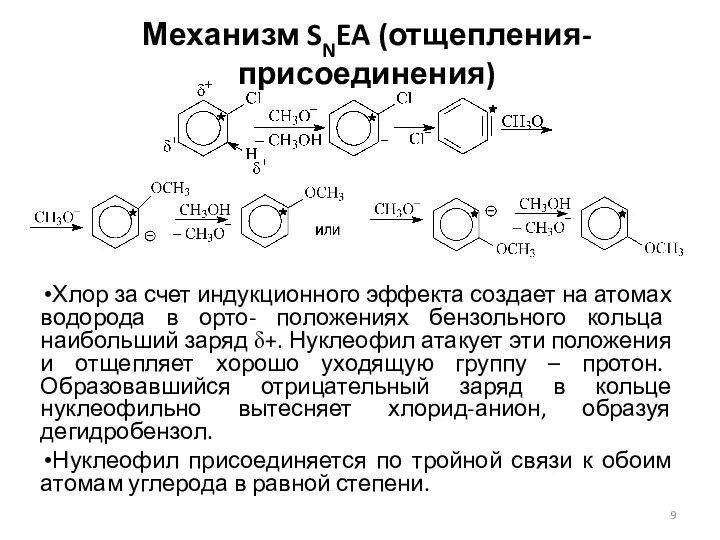
- 9. Механизм SNEA (отщепления-присоединения) Хлор за счет индукционного эффекта создает на атомах водорода в орто- положениях бензольного
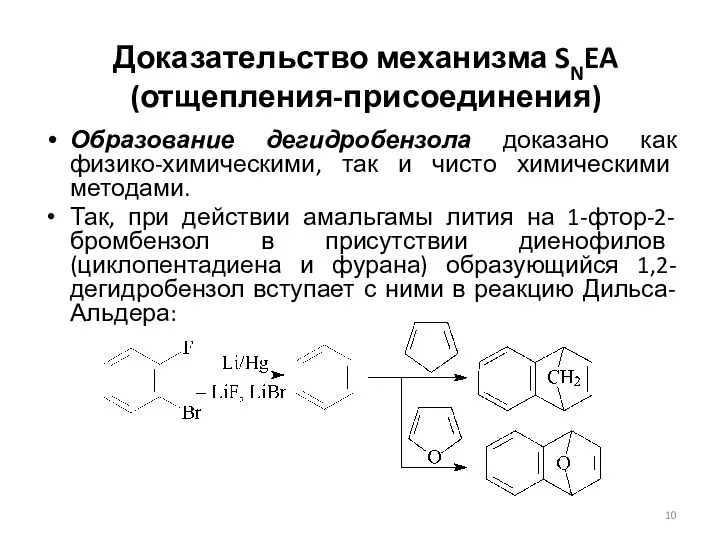
- 10. Доказательство механизма SNEA (отщепления-присоединения) Образование дегидробензола доказано как физико-химическими, так и чисто химическими методами. Так, при
- 11. Влияние строения алифатического субстрата на механизм замещения галогена Увеличение разветвленности радикала создаёт стерические препятствия для прямой
- 12. Влияние аллил- и бензилгалогенидов на механизм замещения галогена Первичные аллил- и бензилгалогениды (тем более разветвленные радикалы)
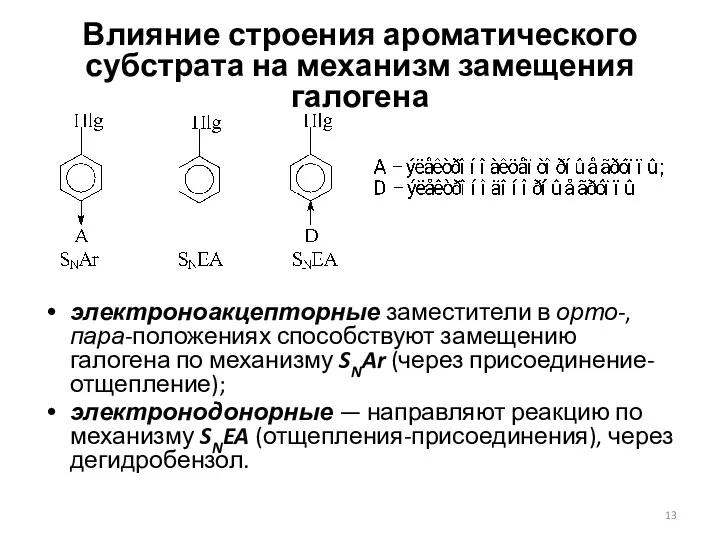
- 13. Влияние строения ароматического субстрата на механизм замещения галогена электроноакцепторные заместители в орто-, пара-положениях способствуют замещению галогена
- 14. Влияние строения алифатического субстрата на скорость SN1 реакции - Скорость SN1 реакции алкилгалогенидов возрастает по мере
- 15. Влияние строения алифатического субстрата на скорость SN2 реакции Скорость SN2 реакции алкилгалогенидов возрастает в прямо противоположном
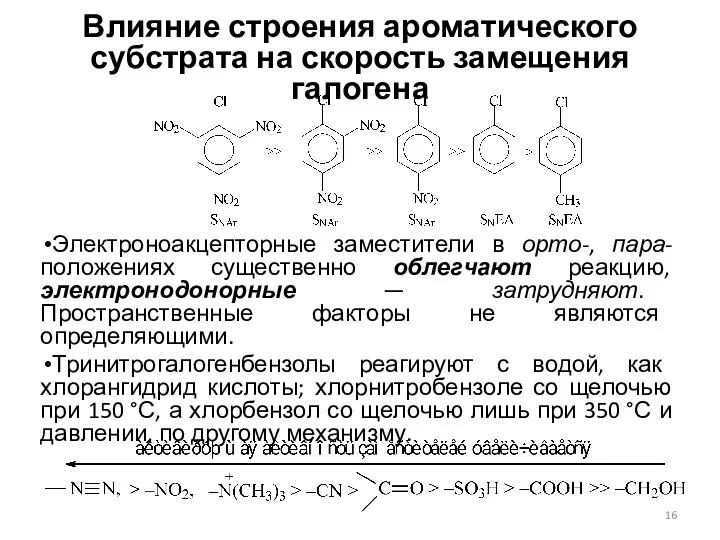
- 16. Влияние строения ароматического субстрата на скорость замещения галогена Электроноакцепторные заместители в орто-, пара-положениях существенно облегчают реакцию,
- 17. Влияние галогена на реакционную способность галогенидов - Галоген является уходящей группой и акцептором электронов. Способность галогена
- 18. Влияние нуклеофила на реакцию чем выше нуклеофильность (активность) реагента, тем вероятнее механизм SN2, слабые нуклеофилы способствуют
- 19. Влияние растворителя на нуклеофильное замещение - столь велико, что часто определяет механизм реакции. Полярные протонные растворители
- 20. Выбор растворителя для SN2 реакции Необходимо учитывать: распределение зарядов в переходном состоянии. Если оно полярнее исходных
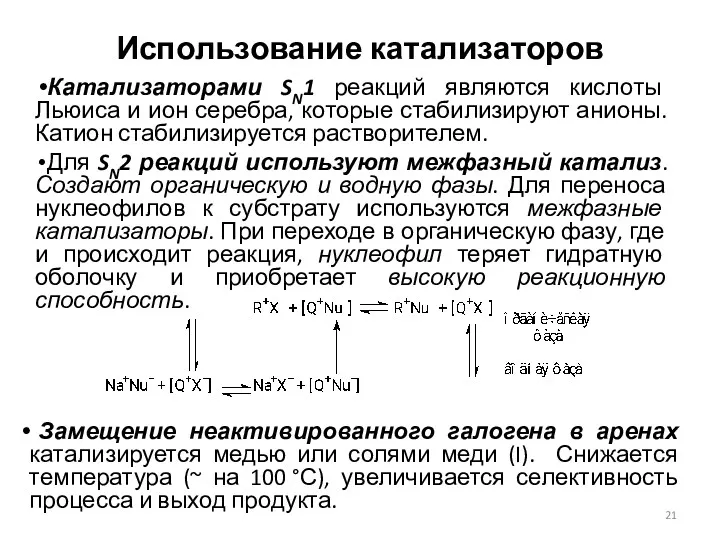
- 21. Использование катализаторов Катализаторами SN1 реакций являются кислоты Льюиса и ион серебра, которые стабилизируют анионы. Катион стабилизируется
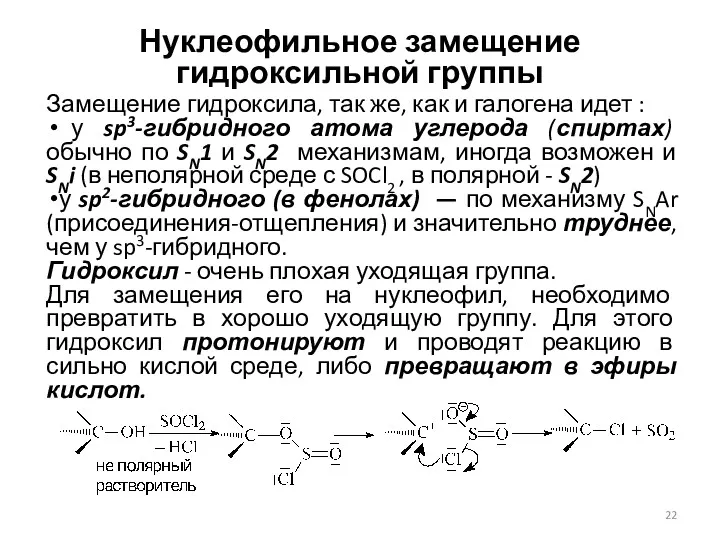
- 22. Нуклеофильное замещение гидроксильной группы Замещение гидроксила, так же, как и галогена идет : у sp3-гибридного атома
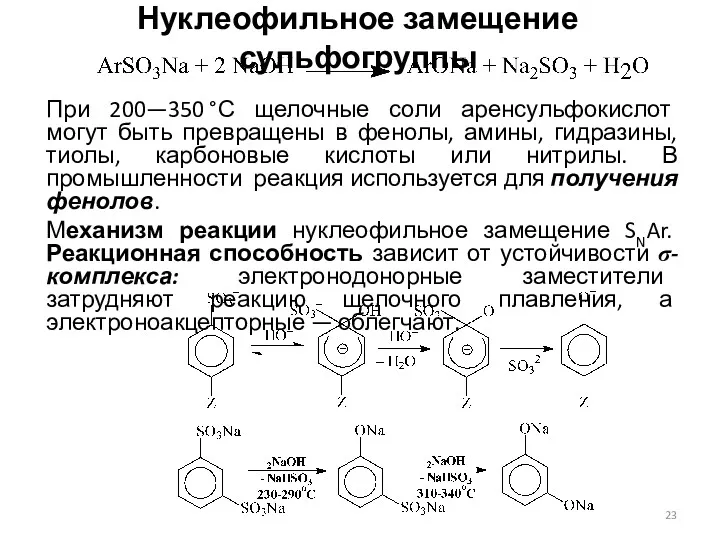
- 23. Нуклеофильное замещение сульфогруппы При 200—350 °С щелочные соли аренсульфокислот могут быть превращены в фенолы, амины, гидразины,
- 24. Самостоятельно Гидролиз галогенидов Получение простых эфиров Получение тиоспиртов, тиоэфиров Получение аминов Получение цианидов Получение сульфокислот
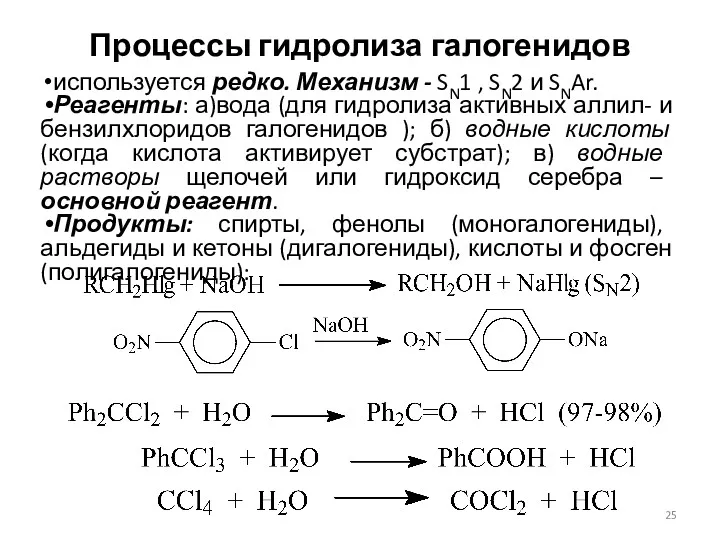
- 25. Процессы гидролиза галогенидов используется редко. Механизм - SN1 , SN2 и SNAr. Реагенты: а)вода (для гидролиза
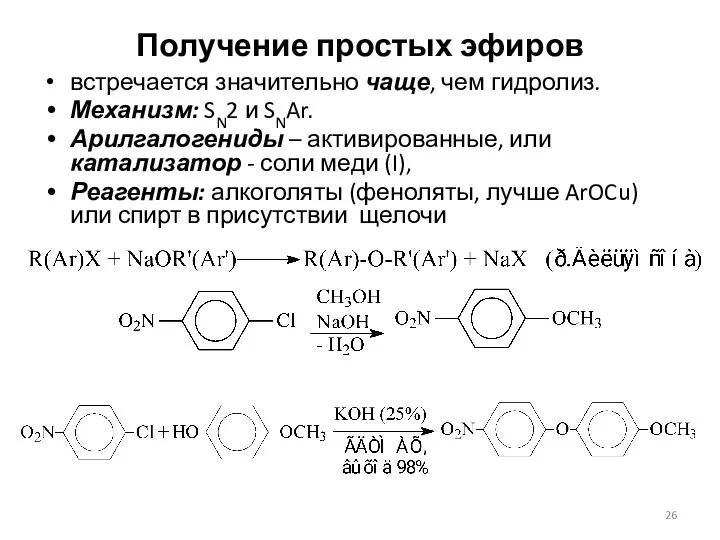
- 26. Получение простых эфиров встречается значительно чаще, чем гидролиз. Механизм: SN2 и SNAr. Арилгалогениды – активированные, или
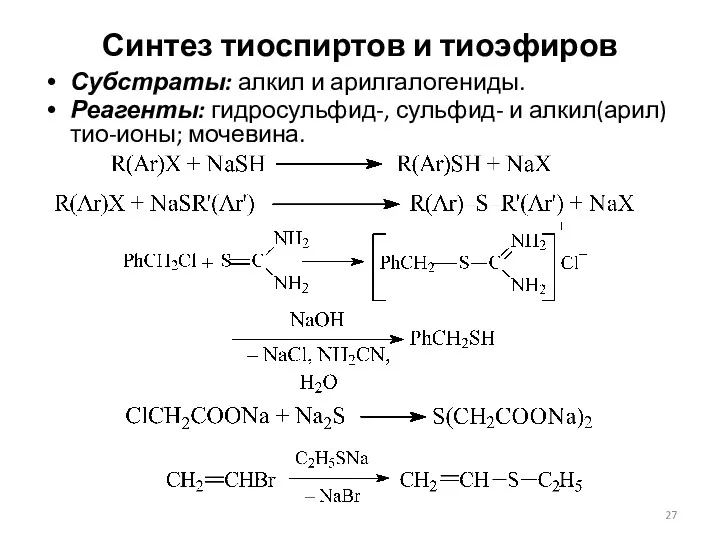
- 27. Синтез тиоспиртов и тиоэфиров Субстраты: алкил и арилгалогениды. Реагенты: гидросульфид-, сульфид- и алкил(арил)тио-ионы; мочевина.
- 28. Замена атома галогена на аминогруппы Особенность реакции первичных, вторичных и третичных алкиламинов с аммиаком и аминами
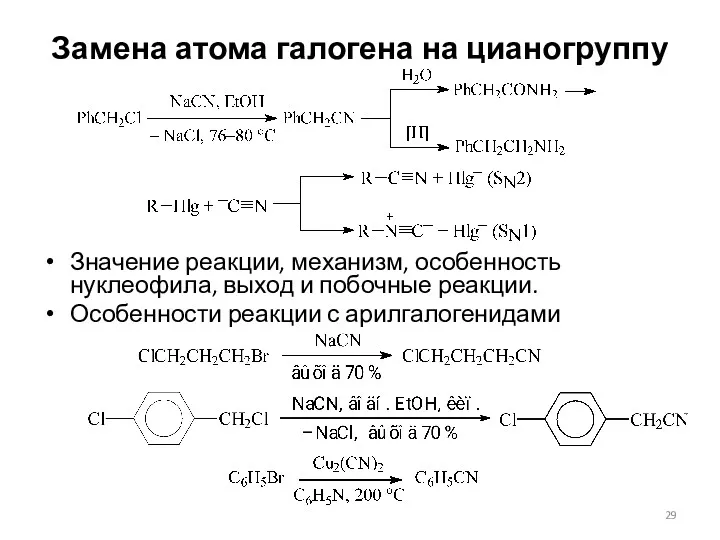
- 29. Замена атома галогена на цианогруппу Значение реакции, механизм, особенность нуклеофила, выход и побочные реакции. Особенности реакции
- 31. Скачать презентацию











 Атомно-кристаллическое строение материалов
Атомно-кристаллическое строение материалов Основания. Классификация оснований
Основания. Классификация оснований Карбонові кислоти
Карбонові кислоти Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты
Химический состав красителей и препаратов для завивки. Лекция 8. Индустрия красоты Породообразующие минералы
Породообразующие минералы Классификация химических реакций
Классификация химических реакций Адсорбция. Физическая и химическая адсорбция
Адсорбция. Физическая и химическая адсорбция Природні гази
Природні гази Произведение растворимости. Строение комплексных соединений
Произведение растворимости. Строение комплексных соединений Пространственное строение молекул органических соединений
Пространственное строение молекул органических соединений Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов)
Углеводы (особенности строения, реакционной способности и методы синтеза альдегидо- и кетоспиртов) Фосфор и его соединения
Фосфор и его соединения Зелёная химия
Зелёная химия Алкены. Этилен
Алкены. Этилен Переработка угля
Переработка угля Возобновляемое сырье органической химии
Возобновляемое сырье органической химии Органічні сполуки: ліпіди
Органічні сполуки: ліпіди Штучні і синтетичні волокна
Штучні і синтетичні волокна Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Обобщение по типам химических реакций
Обобщение по типам химических реакций Щелочные металлы
Щелочные металлы Сульфиды. Занятие 7
Сульфиды. Занятие 7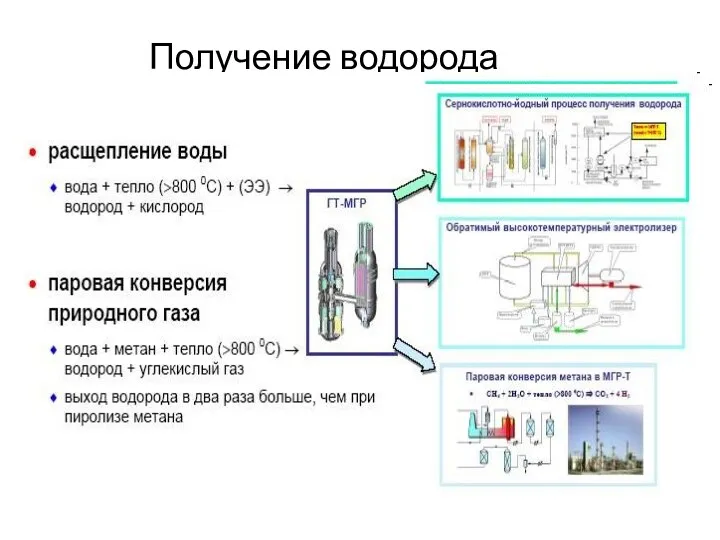 Получение водорода
Получение водорода Сырьевая база промышленной органической химии. Области применения органических веществ. (Лекция 1)
Сырьевая база промышленной органической химии. Области применения органических веществ. (Лекция 1) Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Лекция 6. Алициклические углеводороды (циклоалканы, нафтены)
Лекция 6. Алициклические углеводороды (циклоалканы, нафтены) Производство низших олефинов
Производство низших олефинов Виды топлива
Виды топлива