Содержание
- 2. превращение одних веществ в другие. Вещества, полученные в результате реакции, отличаются от исходных веществ составом, строением
- 3. Признаки химических реакций Появление запаха Выделение газа Изменение окраски Выпадение осадка Растворение осадка Образование воды Выделение
- 4. Классификация по тепловому эффекту Эндотермические – с поглощением тепла + Q Экзотермические – с выделением тепла
- 5. Классификация по числу и составу исходных и образующихся веществ Реакции соединения: А + В = АВ
- 6. Тестовое задание. 1. Соотнесите: Тип реакции Схема реакции 1. замещения; а) 2ΗgO → 2Ηg+O2 ; 2.
- 7. 3. Реакции, в результате которых из одного сложного вещества образуется несколько более простого состава относятся к:
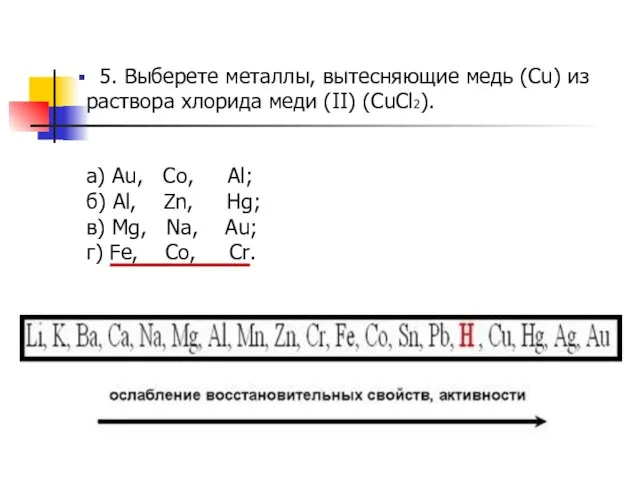
- 8. 5. Выберете металлы, вытесняющие медь (Cu) из раствора хлорида меди (II) (CuCl2). а) Au, Co, Al;
- 9. 6. По данным схемам реакций, запишите уравнения реакций. 1. Гидроксид меди (II) = оксид меди (II)
- 10. 6. Составьте уравнения последовательных реакций, используя подходящие реактивы: а) Ba → BaO → Ba(OH)2 → BaSO4
- 11. Домашнее задание Осуществите цепочку переходов S → SO2 → H2SO3 → Na2SO3 → SO2
- 13. Скачать презентацию









 Польза и вред химического производства
Польза и вред химического производства Серная кислота. Занимательные опыты
Серная кислота. Занимательные опыты Кислородсодержащие органические соединения. 9 класс
Кислородсодержащие органические соединения. 9 класс Хімічні явища в побуті
Хімічні явища в побуті Строение, свойства и классификация аминокислот. Лекция 2
Строение, свойства и классификация аминокислот. Лекция 2 Физические явления. Способы получения чистых химических веществ с помощью физических явлений
Физические явления. Способы получения чистых химических веществ с помощью физических явлений Альдегиды и кетоны
Альдегиды и кетоны Полипропилен
Полипропилен Кислородсодержащие соединения серы. Оксиды серы
Кислородсодержащие соединения серы. Оксиды серы Химия p-элементов
Химия p-элементов Энергоресурсы и их использование
Энергоресурсы и их использование Основные понятия и законы химии
Основные понятия и законы химии Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Химические волокна (7 класс)
Химические волокна (7 класс) Общие проблемы определения низких концентраций
Общие проблемы определения низких концентраций Качественные реакции на органические вещества
Качественные реакции на органические вещества Хімічні властивості карбонових кислот
Хімічні властивості карбонових кислот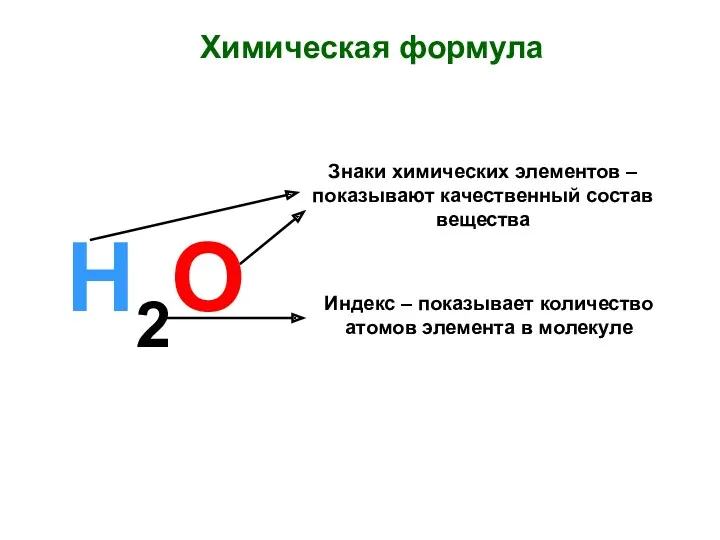 Химическая формула. Знаки химических элементов
Химическая формула. Знаки химических элементов Азот
Азот Глицерин. Основные способы получения
Глицерин. Основные способы получения Жири як представники естерів. Класифікація жирів, їхні хімічні властивості
Жири як представники естерів. Класифікація жирів, їхні хімічні властивості Такой разный песок
Такой разный песок Каучук. Открытие каучука
Каучук. Открытие каучука Щелочные металлы
Щелочные металлы Кристаллохимия как наука
Кристаллохимия как наука Каталитический риформинг бензинов
Каталитический риформинг бензинов Кислородные соединения серы. 2 часть
Кислородные соединения серы. 2 часть Концентрация кобальта
Концентрация кобальта