Содержание
- 2. 1. Предмет и задачи кристаллохимии Кристаллохимия – раздел кристаллографии
- 3. Кристаллография как наука Кристаллография – наука о кристаллах, изучающая их возникновение и рост, внешнюю форму, внутреннее
- 4. Разделы кристаллографии геометрическая кристаллография физическая кристаллография (кристаллофизика), в т. ч. кристаллооптика химическая кристаллография (кристаллохимия, структурная химия)
- 5. Предмет кристаллохимии. Задачи, решаемые кристаллохимией
- 6. Кристаллохимия – раздел химии, изучающий… пространственное расположение и химические связи атомов в кристаллах зависимость физических и
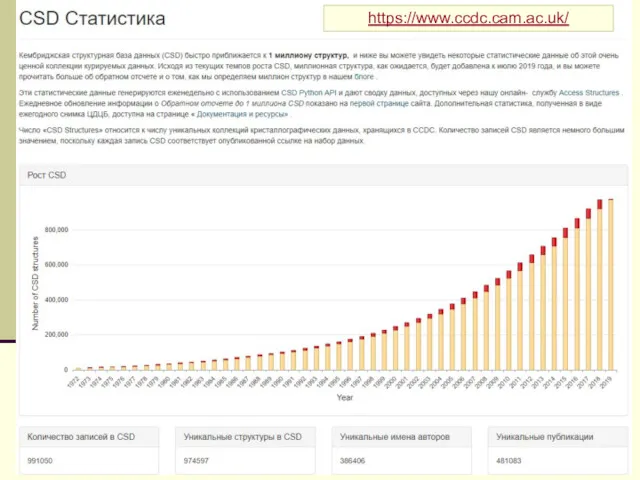
- 7. Центральное понятие кристаллохимии кристаллическая структура 425000 кристаллических структур (на 01.03.2017) > 200000 органических соединений остальные –
- 8. https://www.ccdc.cam.ac.uk/
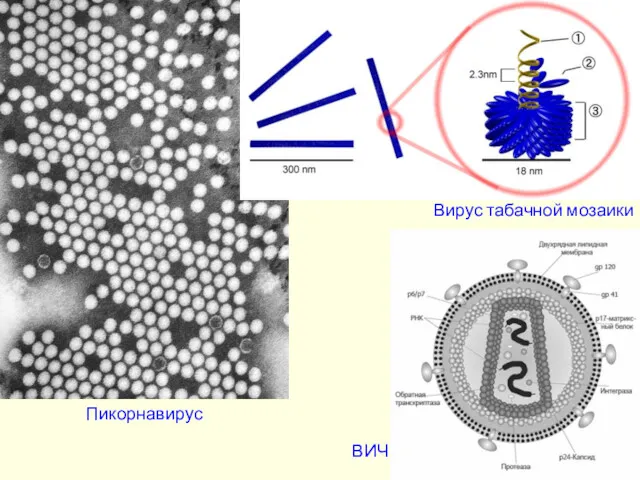
- 9. Пикорнавирус Вирус табачной мозаики ВИЧ
- 10. Предмет кристаллохимии Изучение кристаллических структур и их связи со свойствами веществ
- 11. Объекты изучения кристаллохимии Простые вещества Бинарные (двойные) соединения Тернарные (тройные) соединения Органические кристаллы Биополимеры Другие атомные
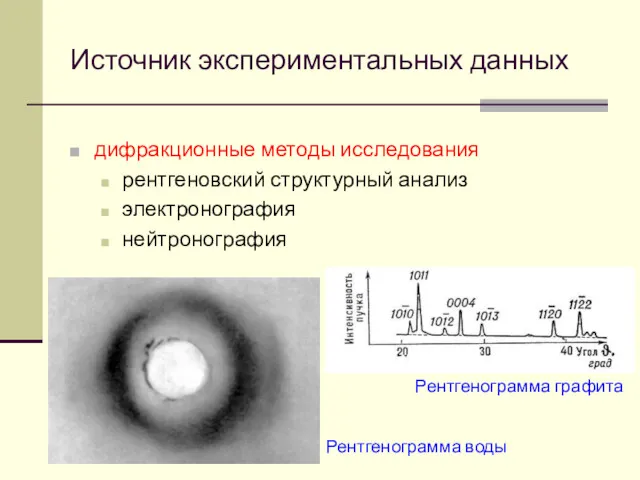
- 12. Источник экспериментальных данных дифракционные методы исследования рентгеновский структурный анализ электронография нейтронография Рентгенограмма графита Рентгенограмма воды
- 13. Аппарат кристаллохимии Теория групп симметрии (точечные группы симметрии, пространственные группы симметрии) Теория химической связи Понятия классической
- 14. Аппарат кристаллохимии Причины образования той или иной кристаллической структуры определяются общим принципом термодинамики наиболее устойчива структура,
- 15. Основные задачи кристаллохимии как построены кристаллические вещества? чем определяется структура каждого конкретного кристаллического вещества? как влияет
- 16. Аспекты кристаллохимии Стереохимический аспект длины связей, валентные углы, координационные числа, координационные полиэдры Кристаллоструктурный аспект анализ относительного
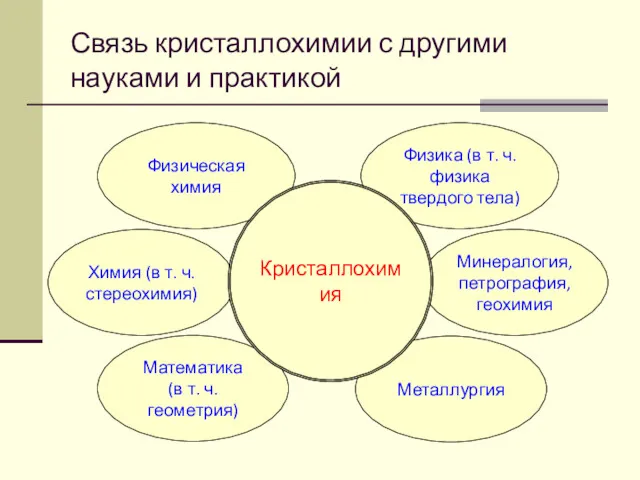
- 17. Связь кристаллохимии с другими науками и практикой
- 18. Связь кристаллохимии с другими науками и практикой использование монокристаллов с различными свойствами (лазерные, люминесцентные, полупроводниковые и
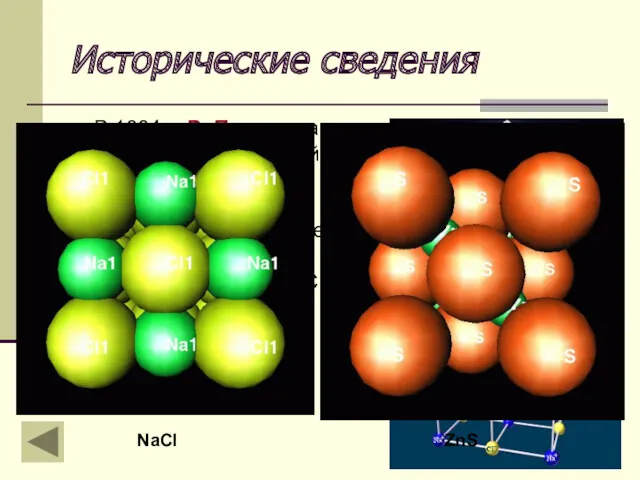
- 19. Исторические сведения Возникновению кристаллохимии предшествовало полуторавековое развитие кристаллографии Были установлены многие черты внутреннего строения кристаллов (Р.
- 20. Исторические сведения Важнейшее достижение этого периода – вывод пространственных групп симметрии (Е. С. Федоров, 1890 г.,
- 21. Исторические сведения В 1884 г. В. Парлоу на основе представлений о плотных шаровых упаковках предсказал некоторые
- 22. Исторические сведения Как наука кристаллохимия сформировалась вскоре после 1912 г., когда М. Лауэ, В. Фридрих и
- 23. Исторические сведения В последние десятилетия ХХ в. У. Г. Брэгг, У. Л. Брэгг и др. изучили
- 24. Исторические сведения Первое существенное достижение теоретической кристаллохимии – расчет энергии ионных кристаллов, выполненный в 1918–1919 гг.
- 25. Исторические сведения В 1926–1927 гг. созданы системы кристаллохимических ионных и атомных радиусов (В. Гольдшмидт, Л. Полинг)
- 26. 2. Кристаллическое состояние вещества
- 27. Кристаллическое состояние вещества (КС) Дальний порядок в расположении частиц (?) Кристаллическая (пространственная) решетка – упорядоченное, закономерное
- 28. Приближение к полностью упорядоченному КС – при Т → 0 К (идеальный кристалл) Реальные тела в
- 29. Основные признаки кристаллов Однородность любые участки кристалла одинаковой формы и одинаково ориентированные, характеризуются одними и теми
- 30. Основные признаки кристаллов Анизотропия (анизотропность, векториальность) большинство физических свойств кристаллических веществ являются одинаковыми по параллельным направлениям
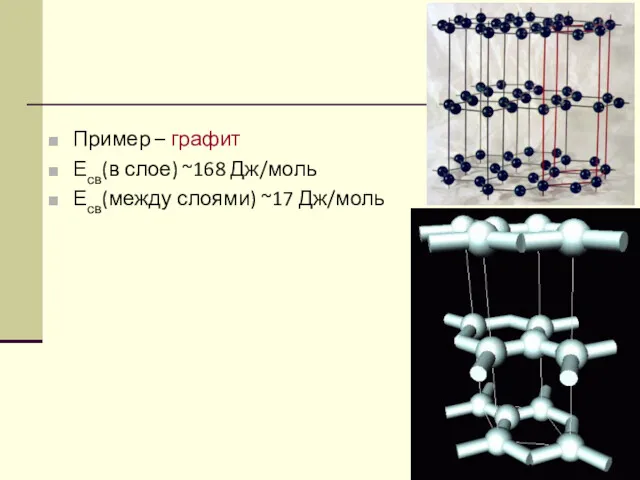
- 31. Пример – графит Есв(в слое) ~168 Дж/моль Есв(между слоями) ~17 Дж/моль
- 32. Основные признаки кристаллов Симметрия при определенных условиях образования кристаллы приобретают форму многогранников Способность самоогранятся выражается в
- 33. Кристаллы отражают кристаллическое строение вещества, т. е. закономерное, упорядоченное расположение мельчайших частиц материи (?) В настоящее
- 34. Гипс – в форме ласточкина хвоста Горный хрусталь – шестигранные призмы в сочетании с дипирамидой или
- 35. Кальцит – в виде ромбоэдров, скаленоэдров, таблитчатых кристаллов
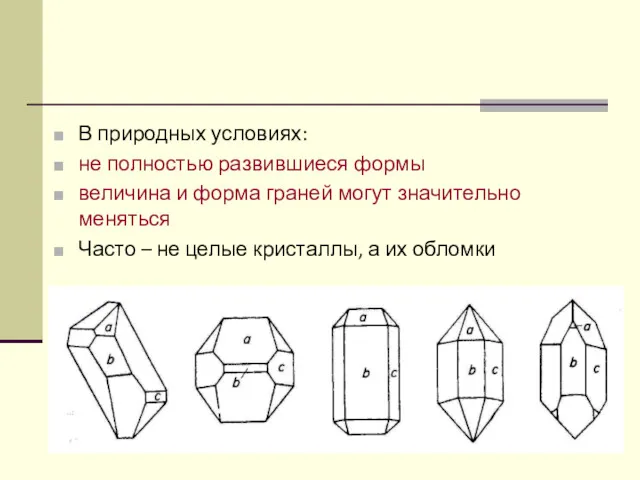
- 36. В природных условиях: не полностью развившиеся формы величина и форма граней могут значительно меняться Часто –
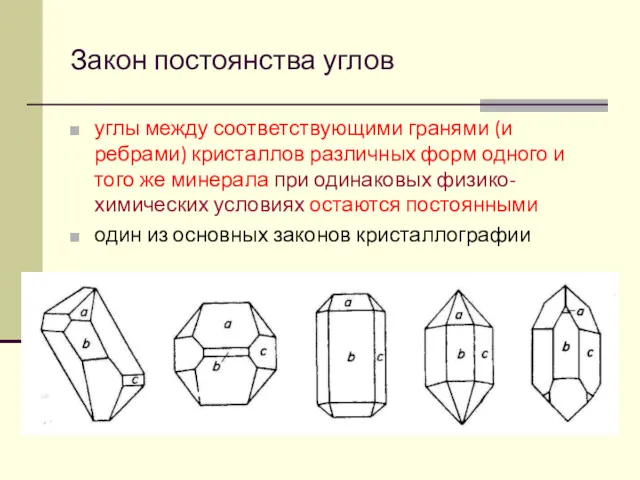
- 37. Закон постоянства углов углы между соответствующими гранями (и ребрами) кристаллов различных форм одного и того же
- 38. Закон постоянства углов справедлив для одинаковых физико-химических условий (Т, р…) Н. Стенсен – в общей форме
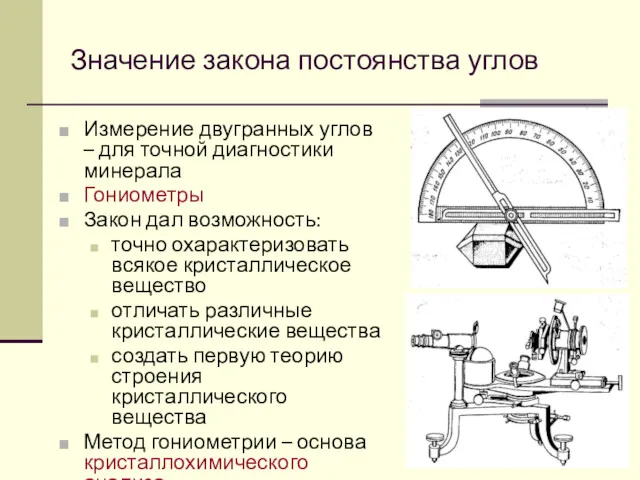
- 39. Значение закона постоянства углов Измерение двугранных углов – для точной диагностики минерала Гониометры Закон дал возможность:
- 40. Некоторые свойства вещества на поверхности кристалла и вблизи от нее существенно отличны от этих свойств внутри
- 41. Большинство тел в КС – поликристаллические, сростки большого числа мелких кристаллитов (зерен) неправильной формы и различно
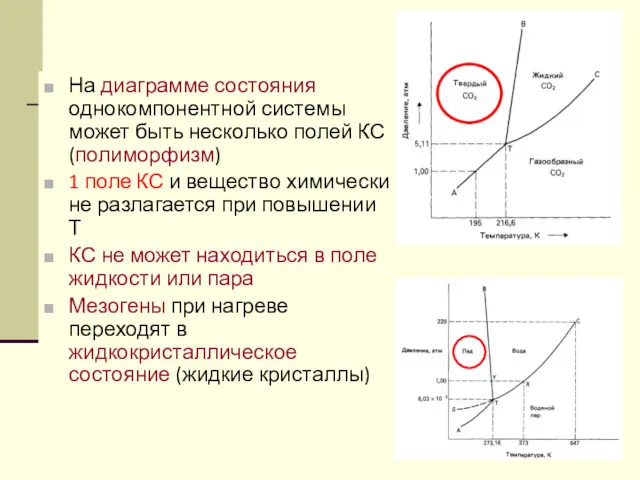
- 42. На диаграмме состояния однокомпонентной системы может быть несколько полей КС (полиморфизм) 1 поле КС и вещество
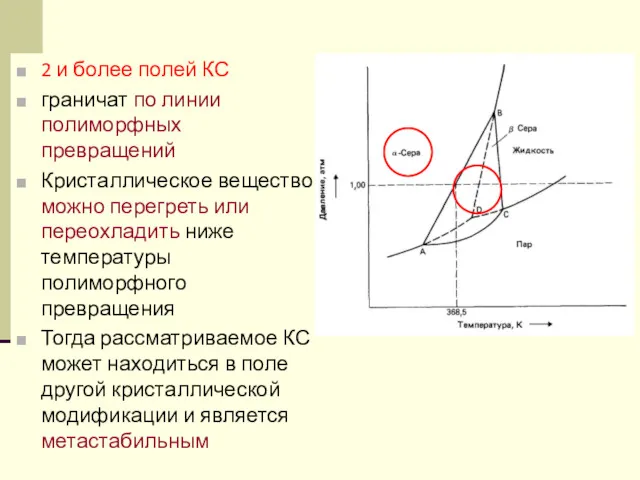
- 43. 2 и более полей КС граничат по линии полиморфных превращений Кристаллическое вещество можно перегреть или переохладить
- 44. Вещество из КС можно перевести в неупорядоченное состояние (аморфное или стеклообразное), не отвечающее минимуму свободной энергии
- 45. 3. Методы вычисления кристаллов
- 46. Вычисление кристаллов… система математической обработки результатов измерения кристаллов на гониометре Е. С. Федоров Г. В. Вульф
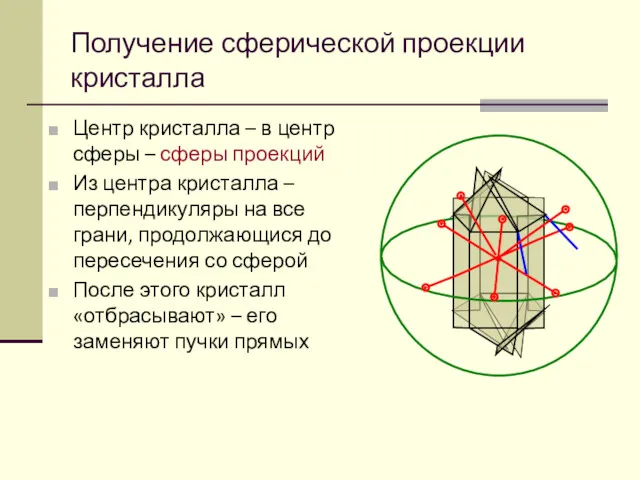
- 47. Центр кристалла – в центр сферы – сферы проекций Из центра кристалла –перпендикуляры на все грани,
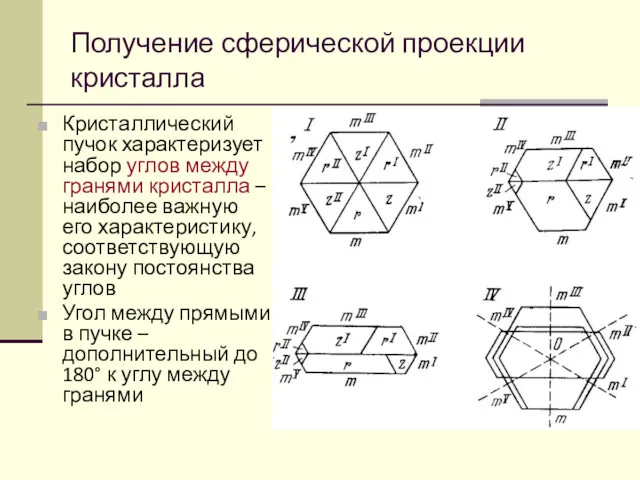
- 48. Кристаллический пучок характеризует набор углов между гранями кристалла – наиболее важную его характеристику, соответствующую закону постоянства
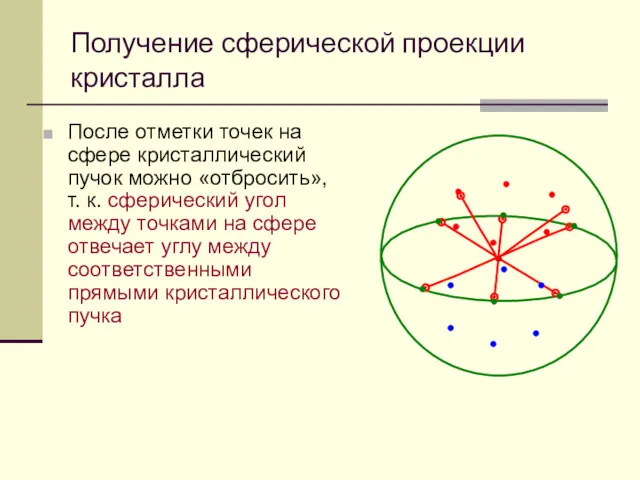
- 49. После отметки точек на сфере кристаллический пучок можно «отбросить», т. к. сферический угол между точками на
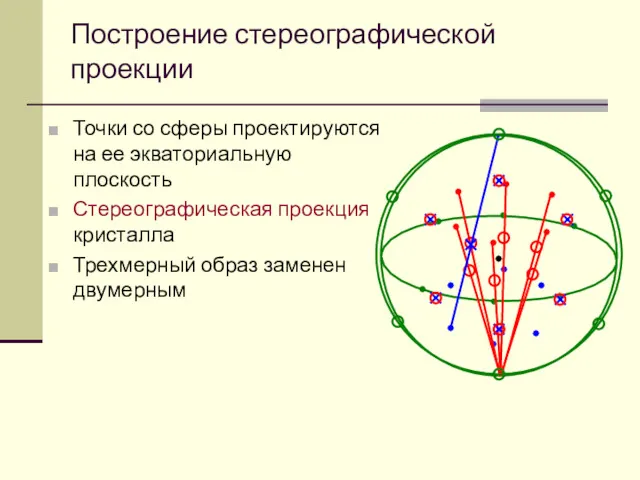
- 50. Построение стереографической проекции Точки со сферы проектируются на ее экваториальную плоскость Стереографическая проекция кристалла Трехмерный образ
- 51. Определение по проекции углов между гранями Сетка Вульфа Георгий Викторович Вульф (1863–1925)
- 52. Проекция делается на кальке, под которую подкладывается транспарант – сетка Вульфа Для измерения угла между двумя
- 53. 4. Кристаллическая структура и способы ее моделирования
- 54. Кристаллическая структура… расположение атомов кристаллического вещества в пространстве Трехмерная периодичность Модели кристаллической структуры Статическая модель –
- 55. Дифракционные методы исследования рентгеноструктурный анализ нейтронография электронография находят: геометрические характеристики кристаллической структуры данные о распределении электронной
- 56. Моделирование кристаллической структуры Идеальная кристаллическая структура характеризуется бесконечной пространственной решеткой, т. е. состоит из идентичных элементарных
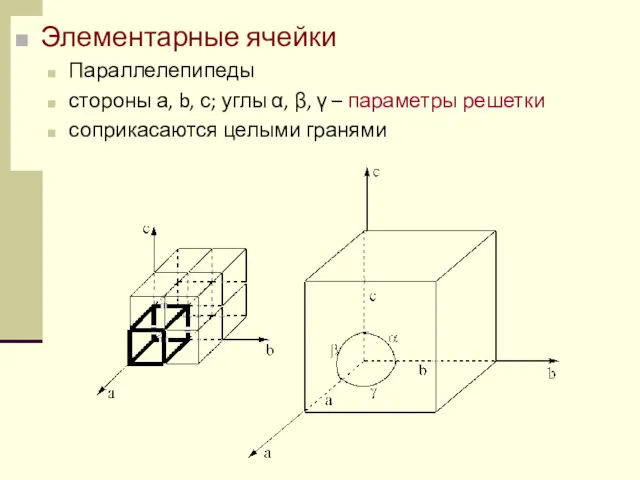
- 57. Элементарные ячейки Параллелепипеды стороны а, b, с; углы α, β, γ – параметры решетки соприкасаются целыми
- 58. 1. Статическая модель кристаллической структуры Указываются: Симметрия кристаллической структуры, выражаемая одной из пространственных (федоровских) групп Параметры
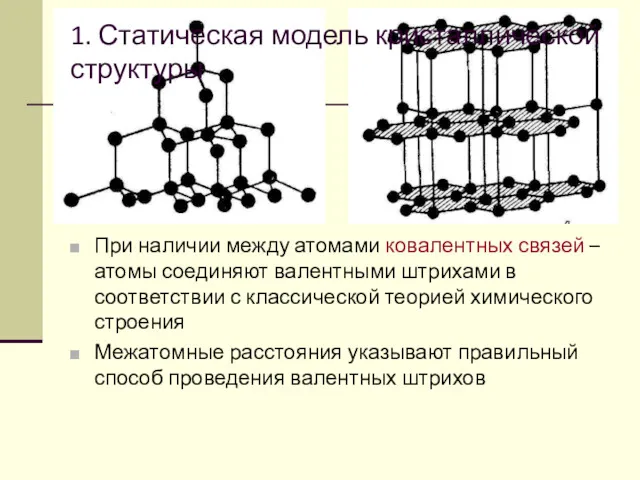
- 59. 1. Статическая модель кристаллической структуры При наличии между атомами ковалентных связей – атомы соединяют валентными штрихами
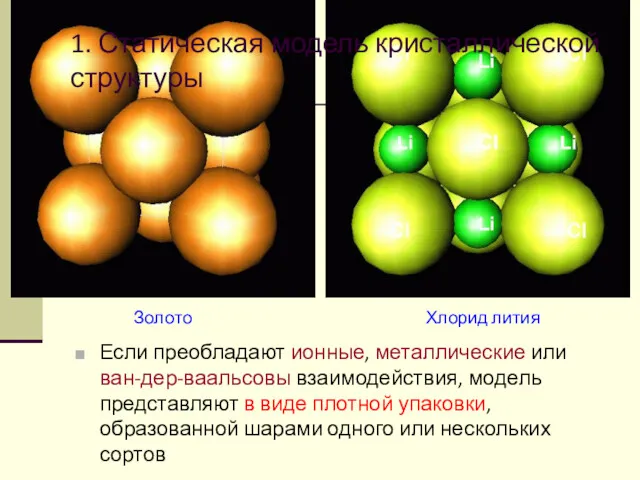
- 60. 1. Статическая модель кристаллической структуры Если преобладают ионные, металлические или ван-дер-ваальсовы взаимодействия, модель представляют в виде
- 61. атомные ядра "погружены" в непрерывно распределенный с плотностью ρ электронный заряд Современный рентгеноструктурный анализ позволяет: экспериментально
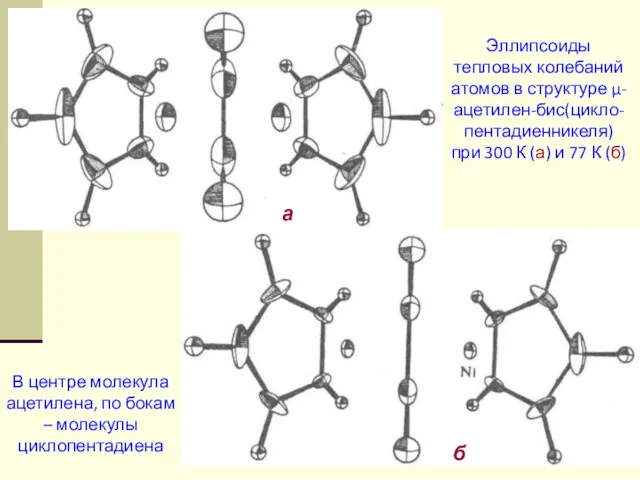
- 62. 3. Динамическая модель Атомы изображают в виде «тепловых эллипсоидов» Физический смысл «тепловых эллипсоидов» – с фиксированной
- 63. В центре молекула ацетилена, по бокам – молекулы циклопентадиена Эллипсоиды тепловых колебаний атомов в структуре μ-ацетилен-бис(цикло-пентадиенникеля)
- 64. 3. Динамическая модель Атомы изображают в виде «тепловых эллипсоидов» Физический смысл «тепловых эллипсоидов» – с фиксированной
- 66. Скачать презентацию










































 Качественные реакции на органические вещества
Качественные реакции на органические вещества Озон
Озон Қарапайым кристалдық құрылымдар
Қарапайым кристалдық құрылымдар Лантаноидтар. Лантаноидтардың қасиеттері
Лантаноидтар. Лантаноидтардың қасиеттері Электрохимические методы анализа
Электрохимические методы анализа Материальный баланс химического реактора. Лекция № 3
Материальный баланс химического реактора. Лекция № 3 Биомакромолекулы. Нуклеиновые кислоты
Биомакромолекулы. Нуклеиновые кислоты Глоссарий
Глоссарий Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот
Kарбонові кислоти. Гетерофункціональні похідні карбонових кислот Метаболизм нуклеотидов
Метаболизм нуклеотидов Уравнения химических реакций
Уравнения химических реакций Тұнбалар мен қайнатпаларды алу принциптері
Тұнбалар мен қайнатпаларды алу принциптері Vitaminele
Vitaminele Алотропні модифікації фосфору
Алотропні модифікації фосфору Защита от коррозии каменных и бетонных строительных материалов и конструкций
Защита от коррозии каменных и бетонных строительных материалов и конструкций Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть
Химические опасности. Токсичные элементы. Мышьяк. Свинец. Ртуть Век пластмасс
Век пластмасс Техника безопасности на уроках химии
Техника безопасности на уроках химии Химия. 6я группа элементов. 9 класс
Химия. 6я группа элементов. 9 класс Нефтепродукты. Продукты переработки нефти
Нефтепродукты. Продукты переработки нефти Генетичні зв’язки між неорганічними речовинами. Практична робота 2
Генетичні зв’язки між неорганічними речовинами. Практична робота 2 Алкены. Химия
Алкены. Химия Относительная молекулярная масса
Относительная молекулярная масса Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2)
Растворы. Дисперсные системы. Термодинамика процесса растворения. (Лекция 2) Бытовая химия в нашем доме и альтернативные способы уборки
Бытовая химия в нашем доме и альтернативные способы уборки Азотистая кислота
Азотистая кислота Простые и сложные вещества. Химический элемент
Простые и сложные вещества. Химический элемент