Содержание
- 3. План 1. История открытия ЭМА 2. Классификация ЭМА 3. Основные понятия электрохимии 4. Потенциометрия 4.1. Прямая
- 4. 1. История открытия Электрохимия является сравнительно новой областью науки и техники. Возникновение электрохимии как науки связано
- 5. История открытия Деви и Фарадей в первой половине XIX в. изучали электролиз. Гемфри Дэви Майкл Фарадей
- 6. История открытия Быстрое развитие электрохимии в конце XIX в. связано с появлением теории электролитической диссоциации Аррениуса
- 7. 2. Классификация ЭМА
- 8. Электрохимические методы анализа (ЭМА) – это совокупность методов качественного и количественного анализа, основанных на электрохимических явлениях,
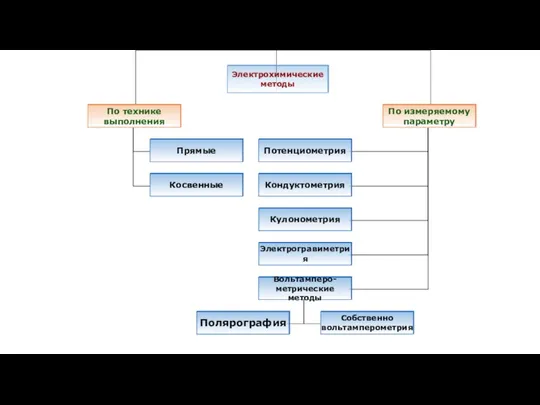
- 9. В зависимости от измеряемого параметра электрохимические методы анализа можно классифицировать следующим образом:
- 10. Классификация ЭМ в зависимости от процессов, происходящих на электродах методы, основанные на электродной реакции, в результате
- 11. Классификация ЭМ в зависимости от процессов, происходящих на электродах методы, основанные на электродной реакции между электродом
- 12. Классификация ЭМ в зависимости от процессов, происходящих на электродах методы, не связанные с электродной реакцией: измеряемый
- 14. 3. Основные понятия электрохимии
- 15. Основной узел любого электрохимического прибора – электрохимическая ячейка. Виды электрохимических ячеек: Гальванический элемент; Электролитическая ячейка.
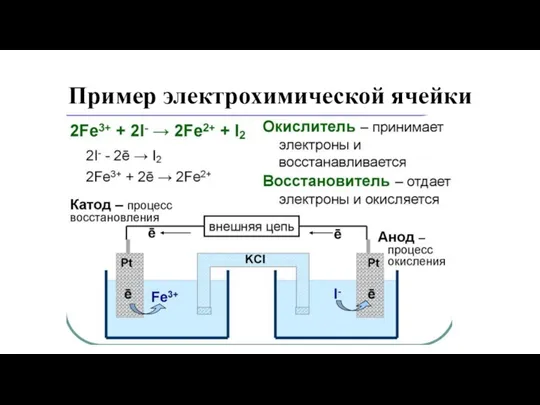
- 16. Пример электрохимической ячейки
- 17. Одним из важнейших (центральных) в электрохимии является понятие электродного потенциала, который обусловлен возникновением двойного электрического слоя
- 18. В качестве токопроводящего материала может быть использован твердый металл (в виде кусочка, пластины, проволоки, порошка, монокристалла),
- 19. Электроды, используемые в электрохимии 1. Электроды первого рода (обратимые относительно катиона, общего с материалом электрода): Металлические
- 20. Электроды, используемые в электрохимии 3. Электроды третьего рода (редокс-электроды): Металлические электроды, погруженные в редокс-систему; Хингидронный электрод.
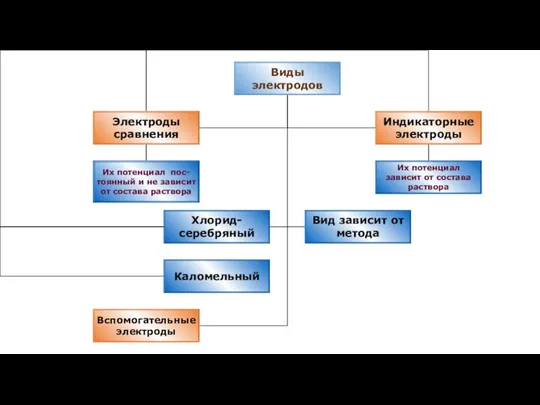
- 22. Электроды сравнения - это электрохимические системы, предназначенные для измерения электродных потенциалов. Необходимость их использования обусловлена невозможностью
- 23. Хлорсеребряный электрод сравнения Представляет собой серебряную пластинку, покрытую слоем хлорида серебра и погруженную в раствор Cl-.
- 24. Каломельный электрод Каломельный электрод (также электрод второго рода) представляет собой ртутный электрод, помещенный в насыщенный раствор
- 25. Водородный электрод сравнения - небольшая платиновая пластинка или сетка, электролитически покрытая платиновой чернью и частично погружена
- 26. Стеклянный электрод Стеклянный электрод является первым мембранным электродом, широко используемым для измерения рН растворов по настоящее
- 27. Стеклянный электрод
- 28. Стеклянный электрод Между внутренним и внешним раствором образуется мембранный потенциал, значение которого является функцией активности ионов
- 29. 4. Потенциометрия
- 30. Потенциометрический анализ - метод определения концентрации ионов, основанный на измерении электрохимического потенциала индикаторного электрода, погруженного в
- 31. Классификация методов потенциометрии Прямая потенциометрия (ионометрия) Потенциометрическое титрование
- 32. 4.1. Прямая потенциометрия (ионометрия)
- 33. Прямая потенциометрия (ионометрия) – это потенциометрический метод, в котором индикаторным электродом является ионоселективный электрод. Ионометрия –
- 34. Особенно широко ионометрия используется при определении точной концентрации ионов Н+ в растворе. В качестве индикаторного электрода,
- 35. В основе метода – зависимость равновесного потенциала индикаторного электрода от концентрации иона в анализируемом растворе, выражаемое
- 36. Если в предыдущее уравнение подставить числовые значения R, F, стандартное значение Т (298 К) и перевести
- 37. При низкой концентрации ионов электролита в растворе вместо активности можно использовать аналитическое значение концентрации ионов:
- 38. Зависимость потенциала водородного электрода от концентрации ионов Н+ в растворе описывается уравнением: E=0,059 pH
- 39. Метод градуировочного графика в ионометрии Метод состоит в измерении потенциала ионоселективного электрода относительно вспомогательного электрода в
- 40. Достоинства ионометрии Метод достаточно прост и экспрессен. Наиболее широко применяется для измерения рН. Точность метода зависит,
- 41. Недостатки ионометрии Ионометрия имеет довольно ограниченную область применения и в основном в лабораторной практике. Объясняется это
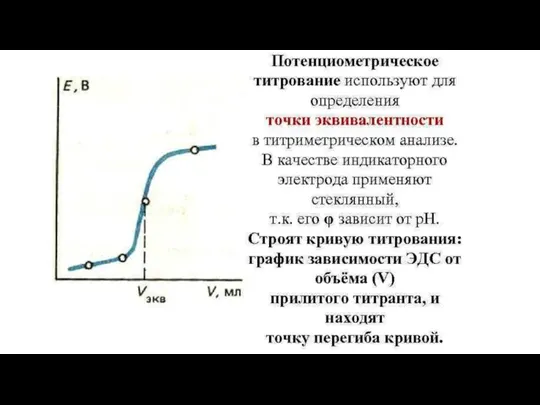
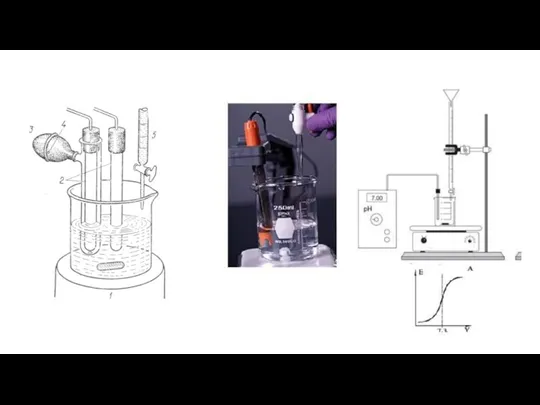
- 42. 4.2. Потетенциометрическое титрование
- 43. Потенциометрическое титрование является разновидностью титриметрических методов анализа. При потенциометрическом титровании анализируемый раствор, находящийся в электрохимической ячейке,
- 46. Достоинства потенциометрического титрования По сравнению с классическим титрованием можно: анализировать разбавленные растворы (до10-6 моль/л); анализировать смеси
- 47. Недостатки метода потенциометрического титрования не всегда быстрое установление потенциала после добавления титранта; необходимость во многих случаях
- 49. Скачать презентацию







































 Моделирование структуры биомакромолекул
Моделирование структуры биомакромолекул Особенности дисперсных систем
Особенности дисперсных систем Inert metals
Inert metals Урок 19. Практична робота №1. Реакції йонного обміну між електролітами у водних розчинах
Урок 19. Практична робота №1. Реакції йонного обміну між електролітами у водних розчинах Циклоалкандар
Циклоалкандар Полімери. Природні полімери
Полімери. Природні полімери Своя игра по химии
Своя игра по химии Алкилсульфонаттарды алу және технологиялық сызбанұсқасы
Алкилсульфонаттарды алу және технологиялық сызбанұсқасы Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів
Графен: синтез, будова та властивості двовимірних вуглецевих матеріалів Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи
Аварийно-химически-опасные вещества (АХОВ). Описание. Методы оказания первой помощи Кислород. Оксиды. Валентность
Кислород. Оксиды. Валентность Введение в органическую химию
Введение в органическую химию Хімія та їжа
Хімія та їжа История становления органической химии
История становления органической химии Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Plastics слайды
Plastics слайды Ртуть. Использование ртути
Ртуть. Использование ртути Газовые гидраты
Газовые гидраты Нуклеофильное замещение галогена и других функциональных групп
Нуклеофильное замещение галогена и других функциональных групп Чипсы: вред или польза
Чипсы: вред или польза Химический элемент хлор
Химический элемент хлор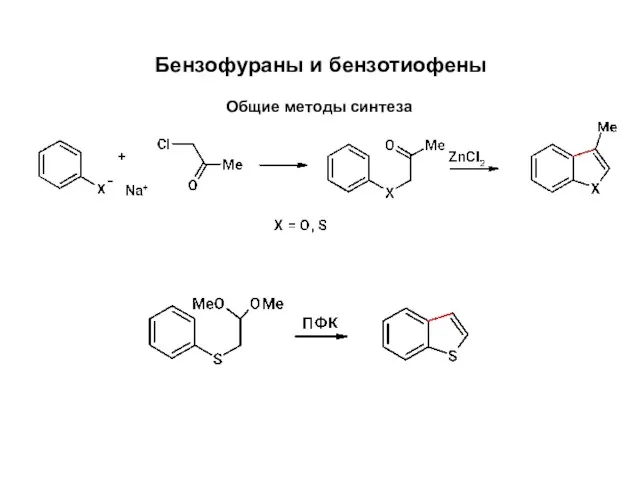 Бензофураны и бензотиофены. Общие методы синтеза
Бензофураны и бензотиофены. Общие методы синтеза Понятие о солях (8 класс)
Понятие о солях (8 класс) Фармацевтическая химия натрия гидрокарбоната
Фармацевтическая химия натрия гидрокарбоната Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн
Метод нейтрализации. Расчёты в методе нейтрализации. Ионное произведение воды. Понятие Рн Электрохимический ряд напряжений металлов. Свойства металлов
Электрохимический ряд напряжений металлов. Свойства металлов Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов