Распространение в природе
Хлор – активный элемент
В природе он встречается только в
виде соединений в составе минералов: галита NaCI,
сильвина KCl,
сильвинита KCl · NaCl,
бишофита MgCl2 · 6H2O,
карналлита KCl · MgCl2 · 6Н2O,
каинита KCl · MgSO4 · 3Н2О.
Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
В организме человека и животных хлор содержится в основном в межклеточных жидкостях (в том числе в крови) и играет важную роль в регуляции осмотических процессов, а также в процессах, связанных с работой нервных клеток.
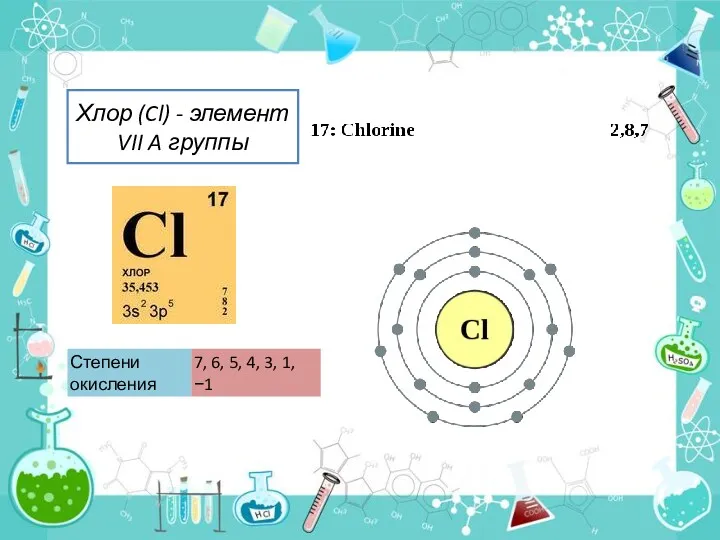
В природе встречаются 2 стабильных изотопа хлора: с массовым числом 35 и 37.








 Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії
Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії Металл цирконий (ZR)
Металл цирконий (ZR) Отчет по прохождению учебной практики. ПАО Акрон
Отчет по прохождению учебной практики. ПАО Акрон Предельные углеводороды. (9 класс)
Предельные углеводороды. (9 класс) Важнейшие минералы
Важнейшие минералы Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Химический состав клетки. Неорганические вещества клетки. 10 класс
Химический состав клетки. Неорганические вещества клетки. 10 класс Строение атома и химическая связь
Строение атома и химическая связь Поверхностные явления. Адсорбция. Изотерма Ленгмюра
Поверхностные явления. Адсорбция. Изотерма Ленгмюра Коллоидная химия
Коллоидная химия Группа веществ, изолируемых полярными растворителями
Группа веществ, изолируемых полярными растворителями Строение и свойства материалов
Строение и свойства материалов Генетическая связь между классами веществ
Генетическая связь между классами веществ Карбоновые кислоты. (Лекция 6.3)
Карбоновые кислоты. (Лекция 6.3) Дисперсные системы
Дисперсные системы Индикаторы. Круговорот воды в природе. Загрязнение природных вод. Охрана и очистка природных вод
Индикаторы. Круговорот воды в природе. Загрязнение природных вод. Охрана и очистка природных вод Неметаллические материалы
Неметаллические материалы Щавелевая кислота
Щавелевая кислота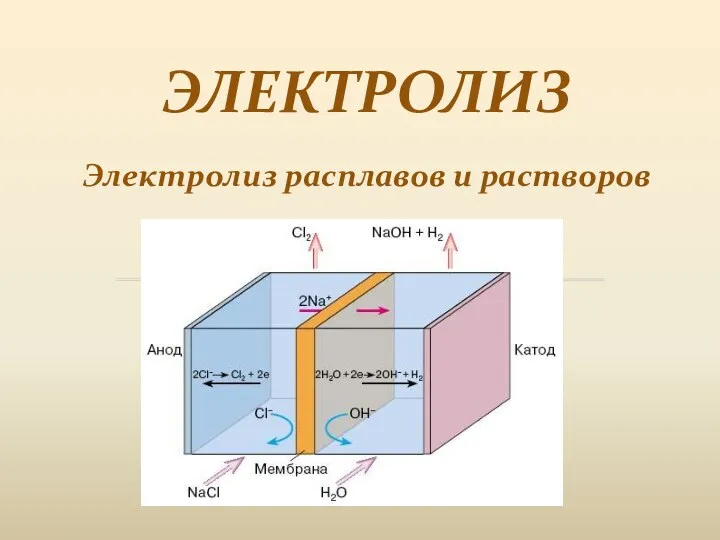 Электролиз. Электролиз расплавов и растворов
Электролиз. Электролиз расплавов и растворов Закономерности изменения свойств элементов в периодах и группах. Химия. 8 класс
Закономерности изменения свойств элементов в периодах и группах. Химия. 8 класс Carbohydrate metabolism
Carbohydrate metabolism Дисперсные системы: общая характеристика и классификация
Дисперсные системы: общая характеристика и классификация Введение. Методы и средства обучения химии
Введение. Методы и средства обучения химии Проект на тему Екзо- та ендотермічні реакції на службі людства
Проект на тему Екзо- та ендотермічні реакції на службі людства Нефть и способы её переработки
Нефть и способы её переработки Окислительные свойства азотной кислоты
Окислительные свойства азотной кислоты Физико-химия дисперсных систем
Физико-химия дисперсных систем Лекция 3. Протолитические равновесия и процессы
Лекция 3. Протолитические равновесия и процессы