Содержание
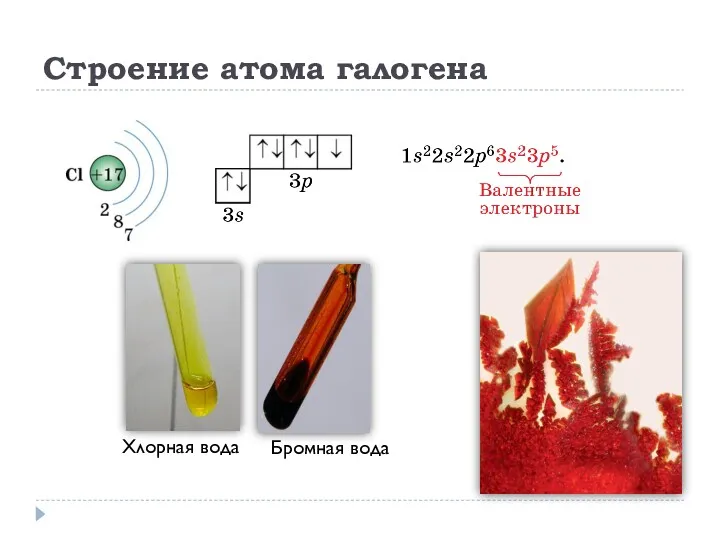
- 2. Строение атома галогена Хлорная вода Бромная вода
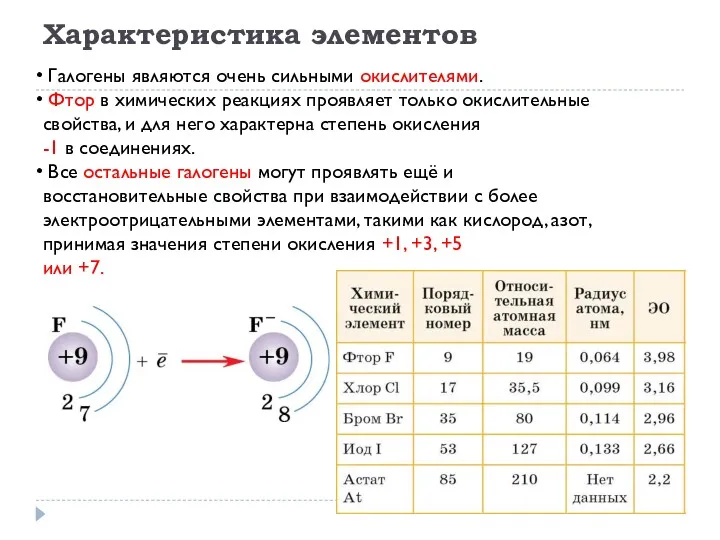
- 3. Характеристика элементов Галогены являются очень сильными окислителями. Фтор в химических реакциях проявляет только окислительные свойства, и
- 4. Простые вещества – галогены Простые вещества состоят их двух атомов! С ростом молекулярной массы, увеличиваются Ткип,
- 5. Анри Муассан 1852–1907 гг. Французский химик. Впервые получил фтор в свободном виде в 1886 г., за
- 6. Французский химик. Открыл бром в 1826 г. В переводе с греческого бромос значит «зловонный», что в
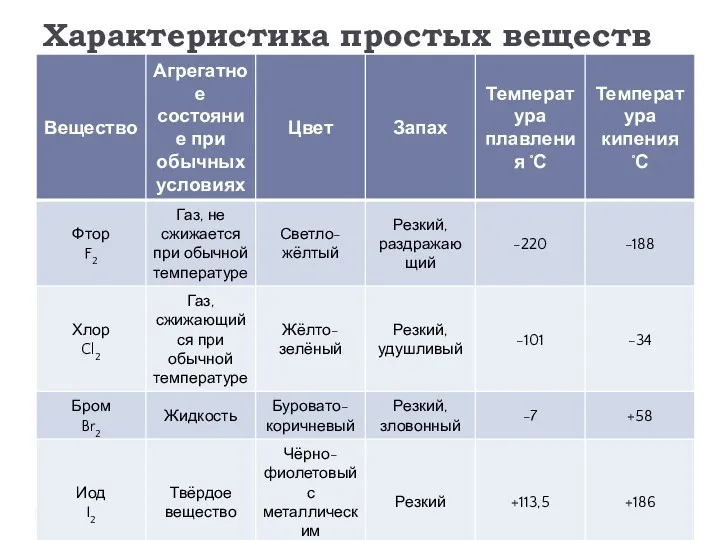
- 7. Характеристика простых веществ
- 8. Н2 + F2 = 2HF H2 + Cl2 =2HCl H2 + Br2 = 2HBr H2 +
- 9. Химические свойства галогенов Взаимодействие галогенов с металлами и неметаллами: 2Ag + F2 = 2AgF 2Fe +
- 10. Взаимодействие галогенов со сложными веществами: Cl2 + 2NaBr = 2NaCl + Br2 Cl2 + 2KI =
- 11. Взаимодействие галогенов со сложными веществами: Химические свойства простых веществ
- 12. Взаимодействие галогенов со сложными веществами: Химические свойства простых веществ
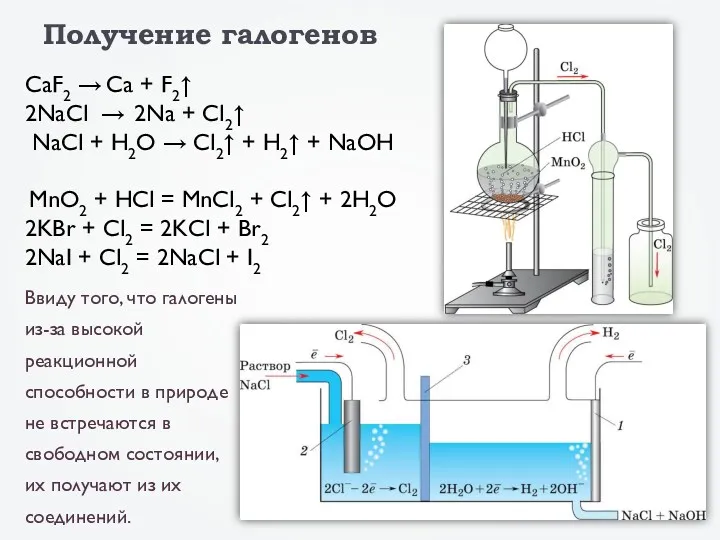
- 13. Ввиду того, что галогены из-за высокой реакционной способности в природе не встречаются в свободном состоянии, их
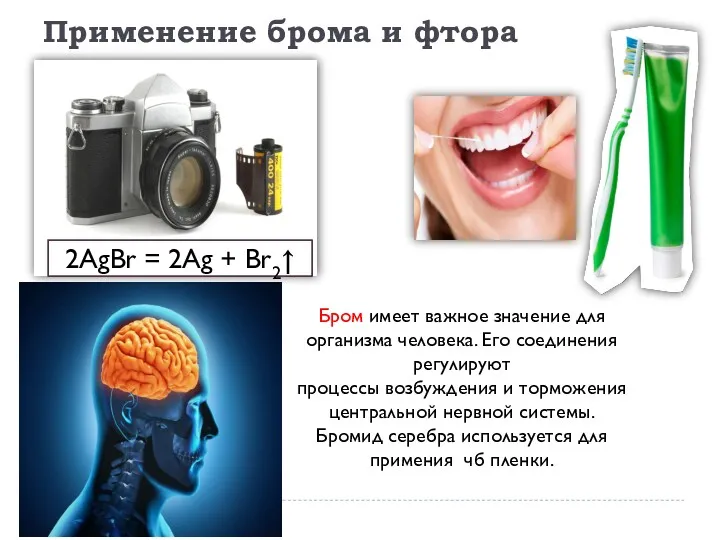
- 14. Применение брома и фтора Бром имеет важное значение для организма человека. Его соединения регулируют процессы возбуждения
- 15. В организм хлор поступает в основном в виде хлорида натрия (поваренной соли). Хлорид натрия обеспечивает нормальный
- 16. Спиртовой раствор йода широко применяют в медицине для дезинфекции. Пятна йода легко смываются содой или спиртом.
- 17. Галогеноводороды. Нахождение в природе. Самыми распространёнными среди галогенов являются хлор, который составляет 0,19% от массы земной
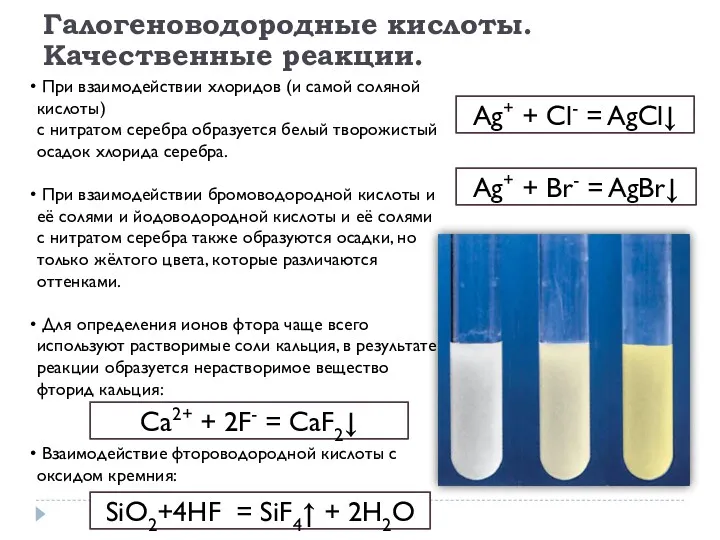
- 18. Галогеноводородные кислоты. Качественные реакции. При взаимодействии хлоридов (и самой соляной кислоты) с нитратом серебра образуется белый
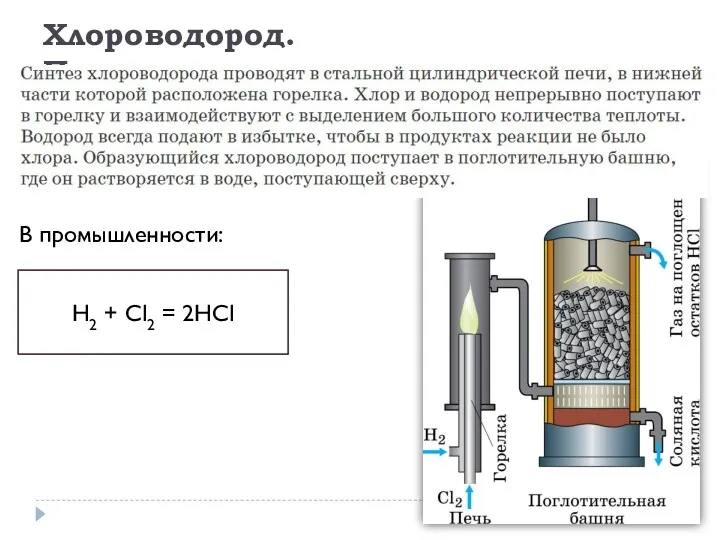
- 19. Получение хлороводорода В промышленности: H2 + Cl2 = 2HCl Хлороводород. Получение
- 20. Хлороводород. Получение В лаборатории: NaCl + H2SO4 = NaHSO4 + HCl В лаборатории используют концентрированную серную
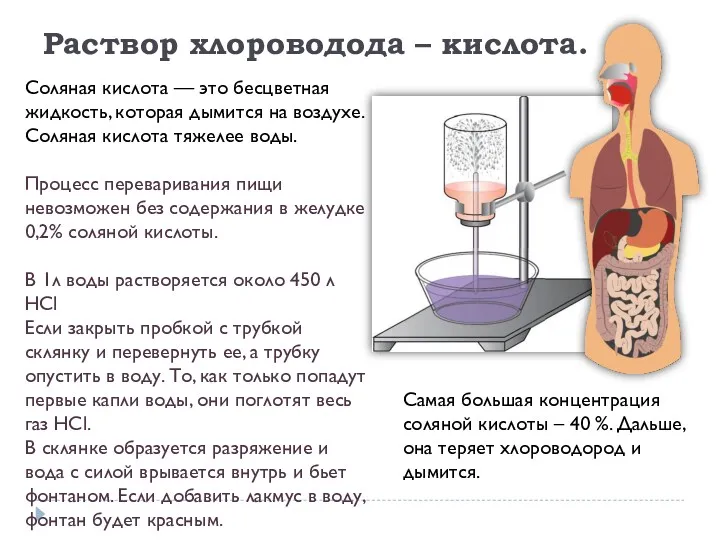
- 21. Соляная кислота — это бесцветная жидкость, которая дымится на воздухе. Соляная кислота тяжелее воды. Процесс переваривания
- 23. Скачать презентацию












 Фенолы+
Фенолы+ Классификация химических реакций
Классификация химических реакций Механизмы органических реакций
Механизмы органических реакций Химия в повседневной жизни человека
Химия в повседневной жизни человека Водород
Водород Нуклеозиды. Нуклеиновые кислоты
Нуклеозиды. Нуклеиновые кислоты Классы неорганических веществ. Классификация неорганических веществ
Классы неорганических веществ. Классификация неорганических веществ Поширення металів у природі
Поширення металів у природі Кислоты. Химические свойства кислот
Кислоты. Химические свойства кислот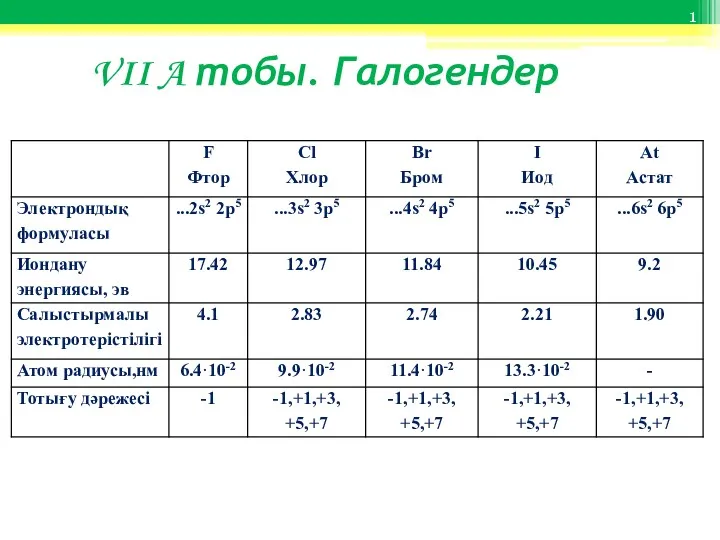 VII A тобы. Галогендер
VII A тобы. Галогендер Агрегатные состояния вещества
Агрегатные состояния вещества Технология производства бутилкаучука
Технология производства бутилкаучука Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс
Природные источники углеводородов, их переработка, применение и экологические проблемы. 10 класс Разделение углеводородных газов
Разделение углеводородных газов Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов
Физико-химические процессы в системе свинец - сталь - кислород, для энергетических ядерных реакторов Будова електронних оболонок атомів
Будова електронних оболонок атомів Свойства химических элементов и закономерность их изменения
Свойства химических элементов и закономерность их изменения Значение органической химии в жизни человека
Значение органической химии в жизни человека Органічні сполуки (9 клас)
Органічні сполуки (9 клас) Майлардың анықтамасы
Майлардың анықтамасы Харчові добавки
Харчові добавки Реакции ионного обмена
Реакции ионного обмена Хімічні властивості оксидів
Хімічні властивості оксидів Колоїдний захист
Колоїдний захист Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит
Силикаты. Слюды. Тальк. Фосфаты. Апатит. Крокоит Алкены (олефины, этиленовые углеводороды)
Алкены (олефины, этиленовые углеводороды) Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Вода на Земле. Строение молекулы воды
Вода на Земле. Строение молекулы воды