Содержание
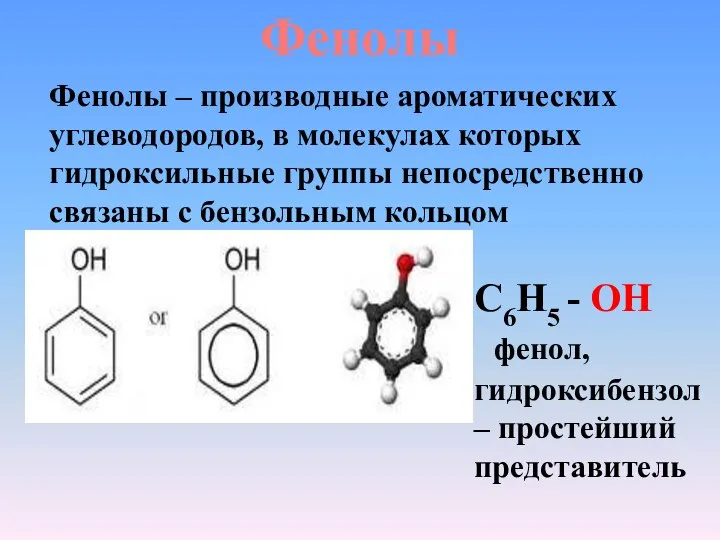
- 3. Фенолы С6Н5 - ОН фенол, гидроксибензол – простейший представитель Фенолы – производные ароматических углеводородов, в молекулах
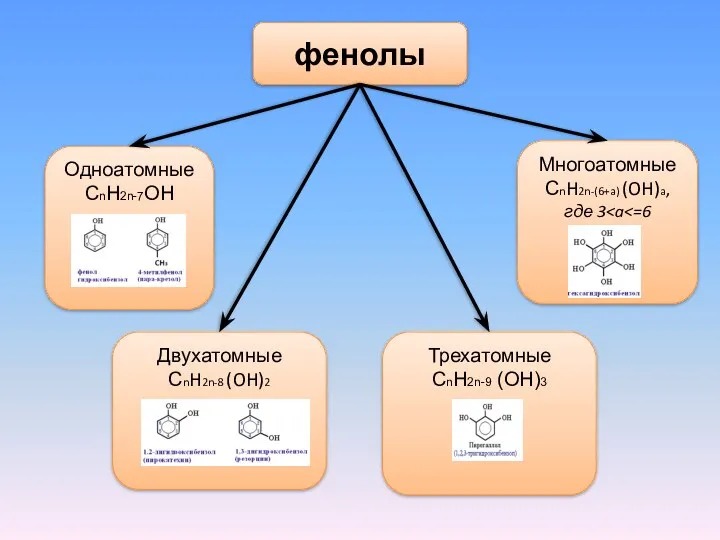
- 4. фенолы Одноатомные СnH2n-7OH Двухатомные СnH2n-8 (OH)2 Многоатомные СnH2n-(6+a) (OH)a, где 3 Трехатомные СnH2n-9 (OH)3
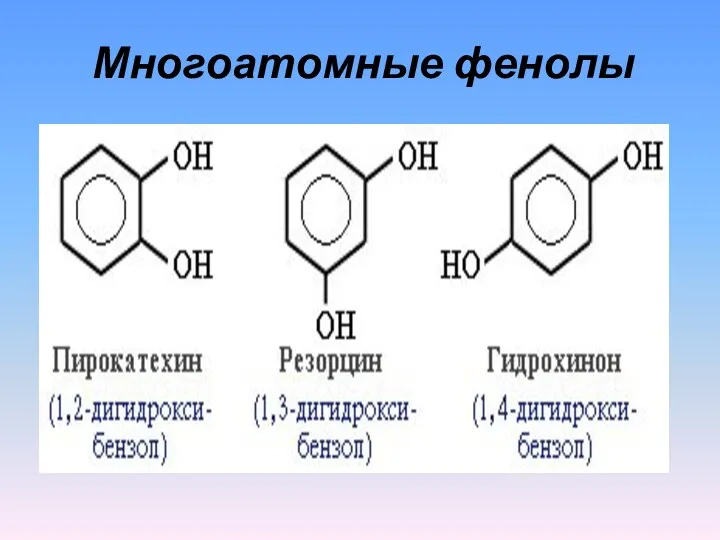
- 5. Многоатомные фенолы
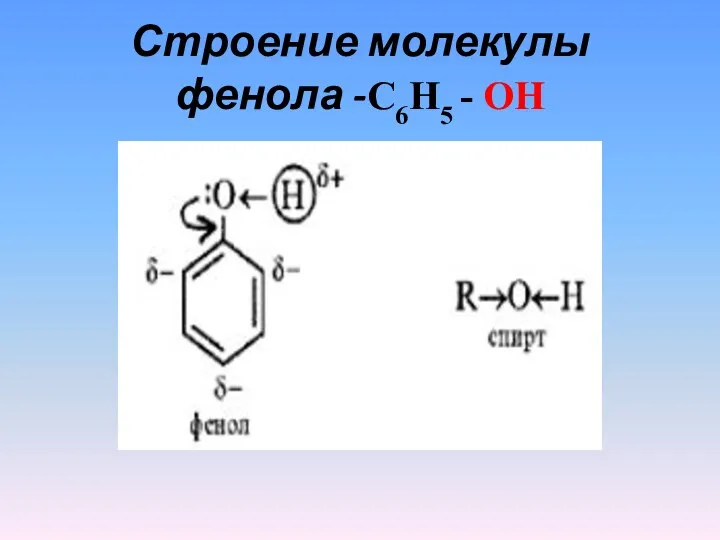
- 6. Строение молекулы фенола -С6Н5 - ОН
- 7. Фенолы Физические свойства Игольчатые бецветные кристаллы с характерным запахом (розовеют на воздухе в результате окисления), мало
- 8. Действие фенола на организм человека При попадании на кожу вызывает ожоги, при воздействии на дыхательные пути
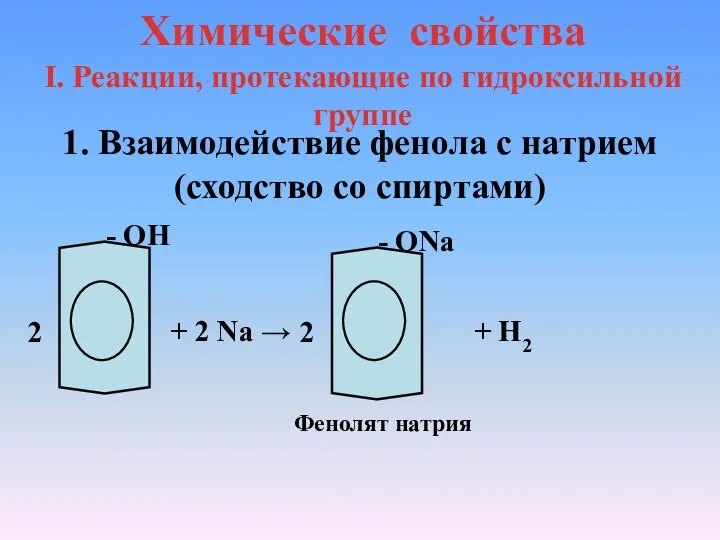
- 9. Химические свойства I. Реакции, протекающие по гидроксильной группе 1. Взаимодействие фенола с натрием(сходство со спиртами) -
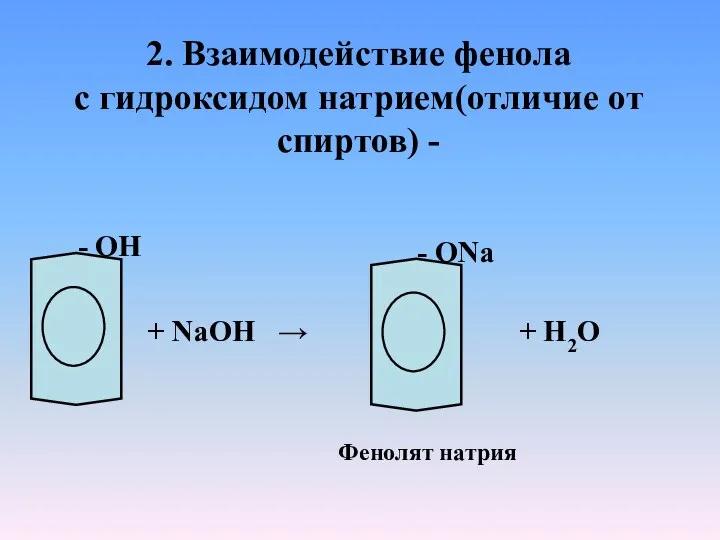
- 10. 2. Взаимодействие фенола с гидроксидом натрием(отличие от спиртов) - - ОН + NaOH → - ОNa
- 11. Химические свойства Кислотные свойства (по группе ОН) 2C6H5O-H + 2Na-OH 2C6H5ONa + H2O фенолят натрия Данная
- 12. Вывод 1: Бензольное кольцо повышает подвижность атома водорода в гидроксильной группе и усиливает кислотные свойства(у фенола
- 13. II.Реакции, протекающие по бензольному кольцу 1. Взаимодействие фенола с бромом при н.у.
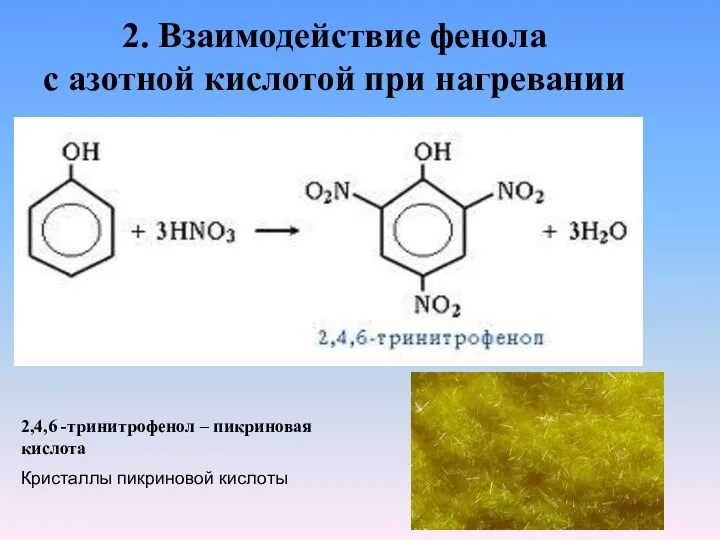
- 14. 2. Взаимодействие фенола с азотной кислотой при нагревании 2,4,6 -тринитрофенол – пикриновая кислота Кристаллы пикриновой кислоты
- 15. Вывод 2: Гидроксильная группа обуславливает более лёгкое замещение атомов водорода в бензольном кольце в положениях 2,4,6.
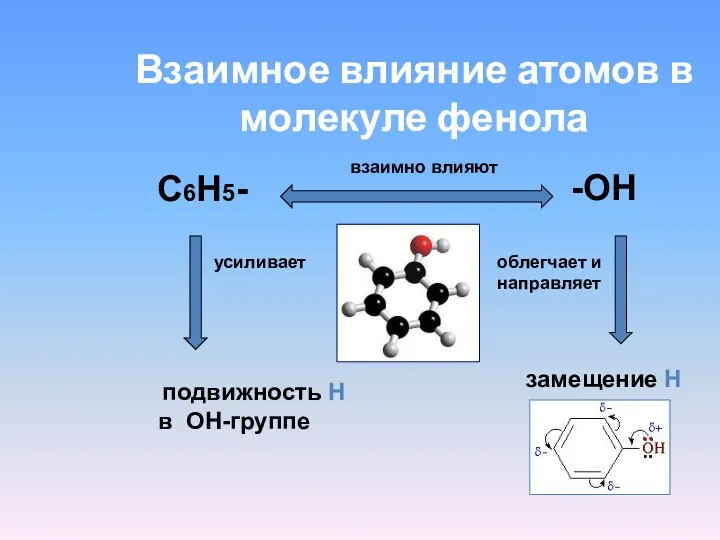
- 16. Взаимное влияние атомов в молекуле фенола С6Н5- -ОН взаимно влияют усиливает облегчает и направляет подвижность Н
- 17. 3. Гидрирование + 3 Н2 → циклогексанол
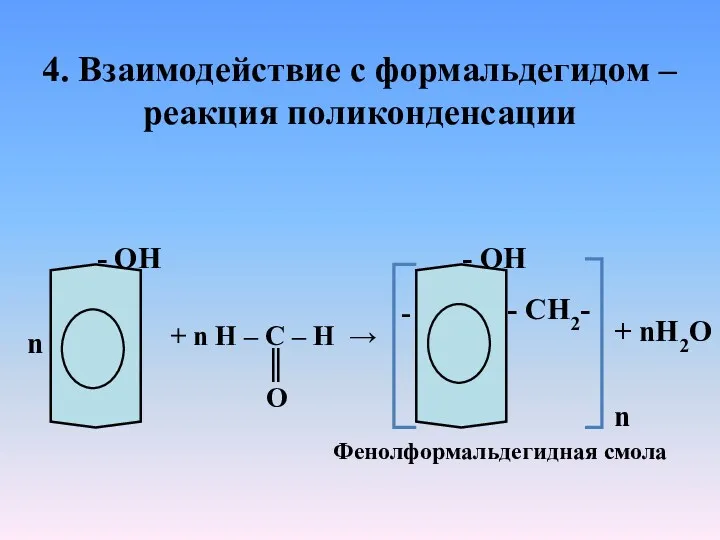
- 18. 4. Взаимодействие с формальдегидом – реакция поликонденсации n - ОН + n H – C –
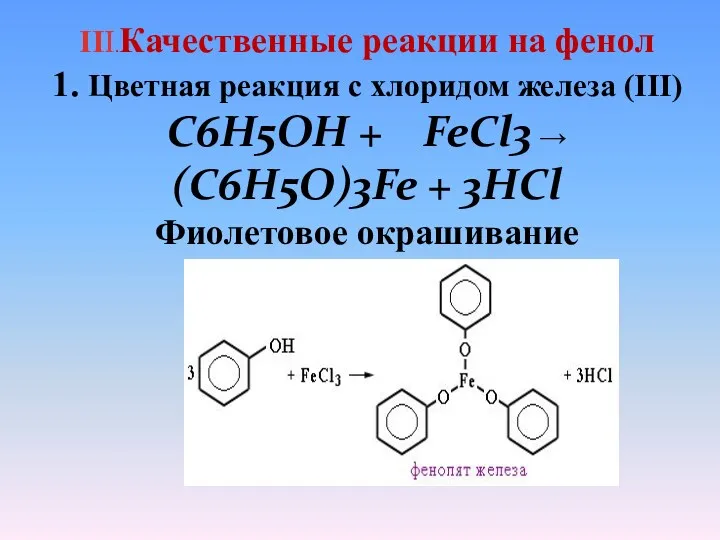
- 19. III.Качественные реакции на фенол 1. Цветная реакция с хлоридом железа (III) C6H5OH + FeCl3 → (C6H5O)3Fe
- 20. 2. Взаимодействие с бромной водой при н. у. Белый кристаллический осадок C6H5OH + FeCl3 фиолетовое окрашивание
- 21. Фенолы Практическое значение
- 22. Применение фенола Взрывчатые вещества красители пестициды Лекарственные вещества клеи Полимеры Древесно-стружечные плиты
- 23. Применение
- 24. Фенолфталеи́н (4,4'-диоксифталофенон или 3,3-бис-(4-гидроксифенил)фталид)
- 25. Фенолы в природе.
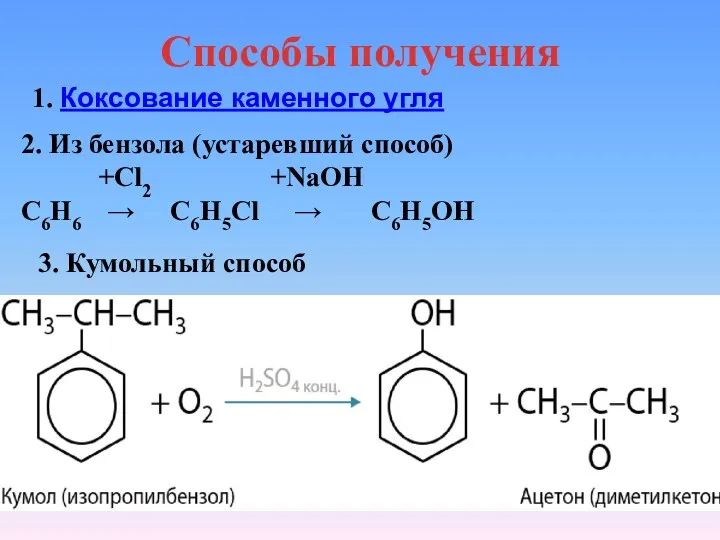
- 26. Способы получения 1. Коксование каменного угля 2. Из бензола (устаревший способ) +Cl2 +NaOH С6Н6 → С6Н5Сl
- 28. Скачать презентацию













 Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії
Електронні і графічні електронні формули атомів s-, p-, d- елементів. Принцип Мінімальної енергії Металл цирконий (ZR)
Металл цирконий (ZR) Отчет по прохождению учебной практики. ПАО Акрон
Отчет по прохождению учебной практики. ПАО Акрон Предельные углеводороды. (9 класс)
Предельные углеводороды. (9 класс) Важнейшие минералы
Важнейшие минералы Неметаллы: общая характеристика. 9 класс
Неметаллы: общая характеристика. 9 класс Химический состав клетки. Неорганические вещества клетки. 10 класс
Химический состав клетки. Неорганические вещества клетки. 10 класс Строение атома и химическая связь
Строение атома и химическая связь Поверхностные явления. Адсорбция. Изотерма Ленгмюра
Поверхностные явления. Адсорбция. Изотерма Ленгмюра Коллоидная химия
Коллоидная химия Группа веществ, изолируемых полярными растворителями
Группа веществ, изолируемых полярными растворителями Строение и свойства материалов
Строение и свойства материалов Генетическая связь между классами веществ
Генетическая связь между классами веществ Карбоновые кислоты. (Лекция 6.3)
Карбоновые кислоты. (Лекция 6.3) Дисперсные системы
Дисперсные системы Индикаторы. Круговорот воды в природе. Загрязнение природных вод. Охрана и очистка природных вод
Индикаторы. Круговорот воды в природе. Загрязнение природных вод. Охрана и очистка природных вод Неметаллические материалы
Неметаллические материалы Щавелевая кислота
Щавелевая кислота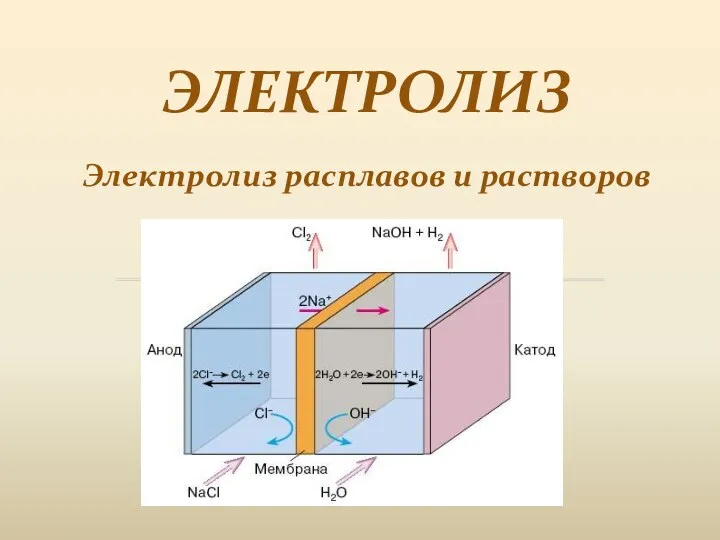 Электролиз. Электролиз расплавов и растворов
Электролиз. Электролиз расплавов и растворов Закономерности изменения свойств элементов в периодах и группах. Химия. 8 класс
Закономерности изменения свойств элементов в периодах и группах. Химия. 8 класс Carbohydrate metabolism
Carbohydrate metabolism Дисперсные системы: общая характеристика и классификация
Дисперсные системы: общая характеристика и классификация Введение. Методы и средства обучения химии
Введение. Методы и средства обучения химии Проект на тему Екзо- та ендотермічні реакції на службі людства
Проект на тему Екзо- та ендотермічні реакції на службі людства Нефть и способы её переработки
Нефть и способы её переработки Окислительные свойства азотной кислоты
Окислительные свойства азотной кислоты Физико-химия дисперсных систем
Физико-химия дисперсных систем Лекция 3. Протолитические равновесия и процессы
Лекция 3. Протолитические равновесия и процессы