Все клетки, независимо от уровня организации, сходны по химическому составу. В
живых организмах обнаружено около 80 химических элементов периодической системы Д.И.Менделеева.
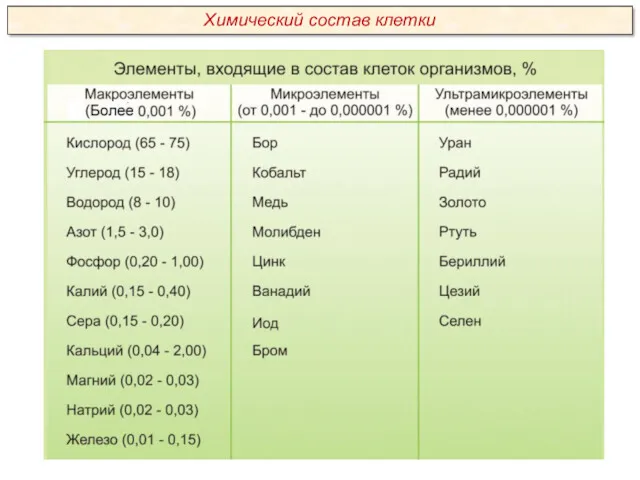
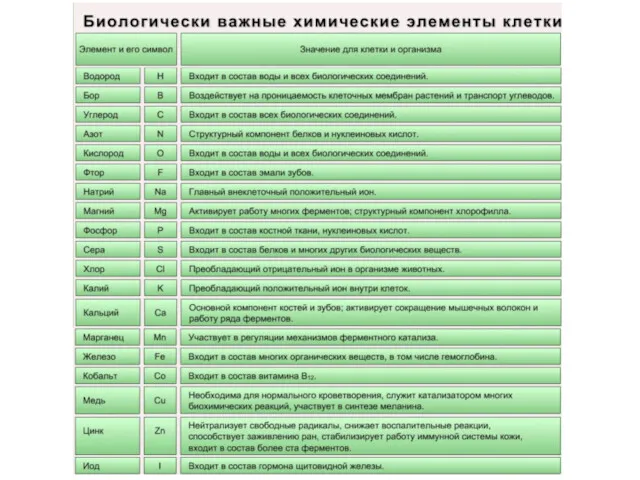
Для 26 элементов известны функции, которые они выполняют в клетке. Эти элементы называются биогенными. По количественному содержанию в живом веществе элементы делятся на три категории:
Макроэлементы:
O, C, H, N – около 98% от массы клетки, элементы 1-ой группы;
K, Na, Ca, Mg, S, P, Cl, Fe – 1,9 % от массы клетки, элементы 2-ой группы. К макроэлементам относят элементы, концентрация которых превышает 0,001%. Они составляют основную массу живого вещества клетки.
Микроэлементы:
( Zn, Mn, Cu, Co, Mo и многие другие), доля которых составляет от 0,001% до 0,000001% (0,1 % массы клетки). Входят в состав биологически активных веществ – ферментов, витаминов и гормонов.
Ультрамикроэлементы:
(Au, U, Ra и др.), концентрация которых не превышает 0,000001%. Роль большинства элементов этой группы до сих пор не выяснена.
Химический состав клетки




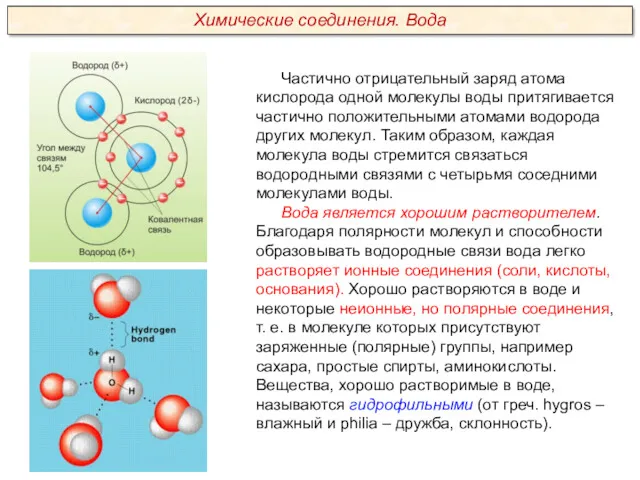
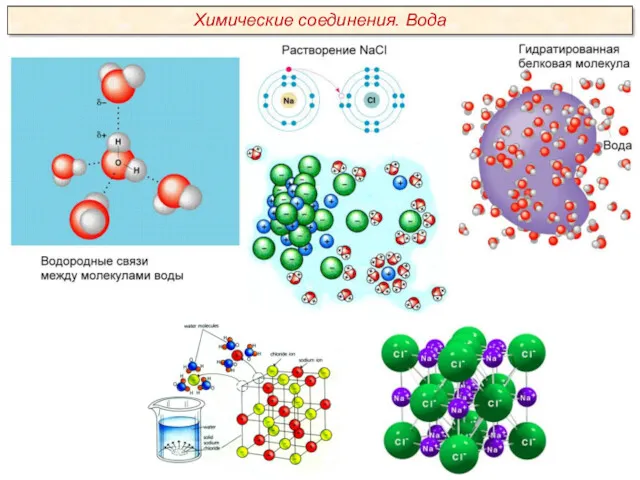
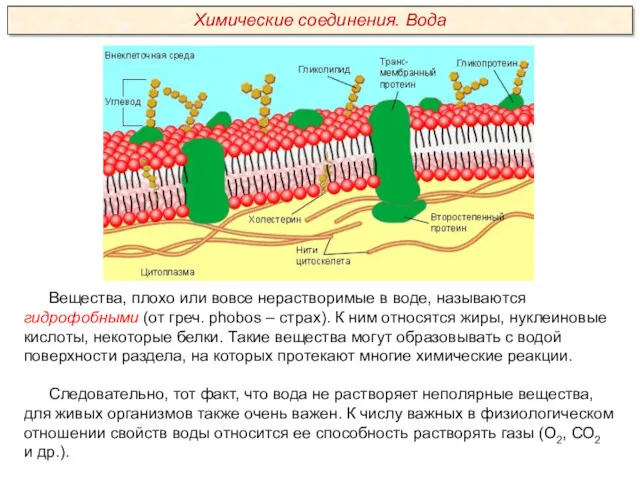
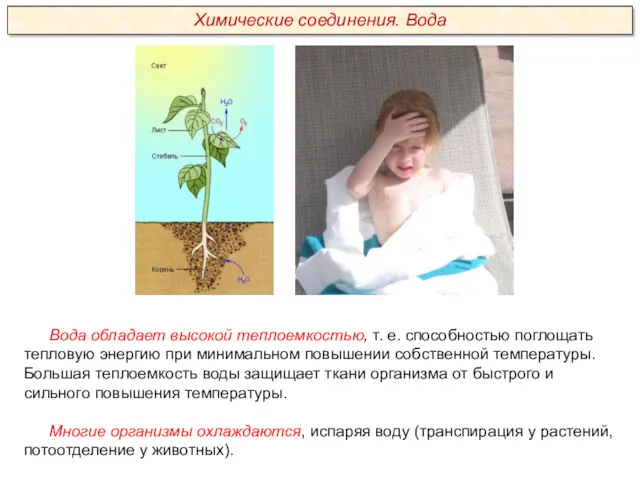
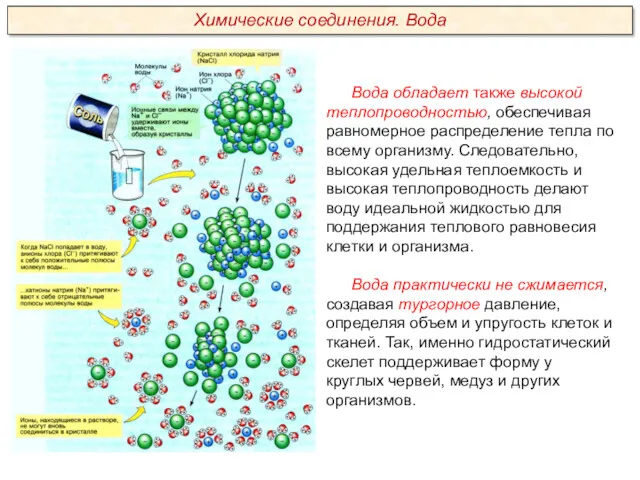
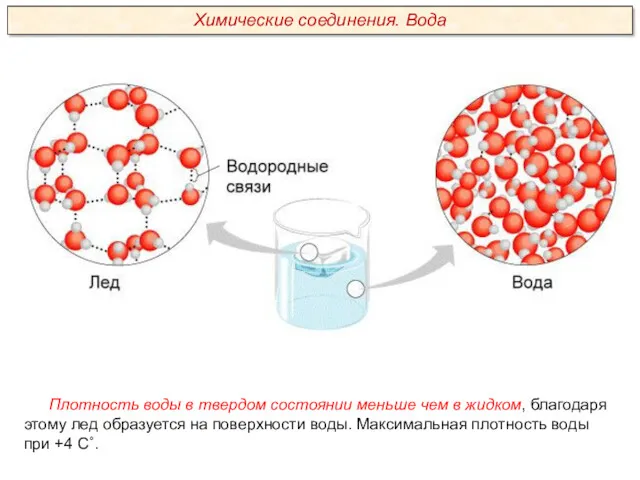

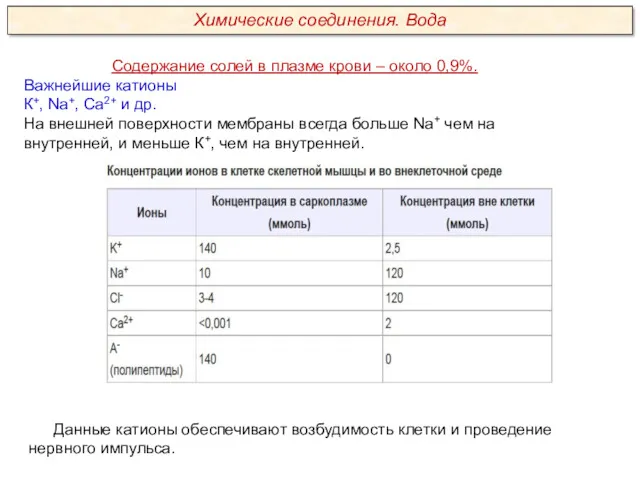

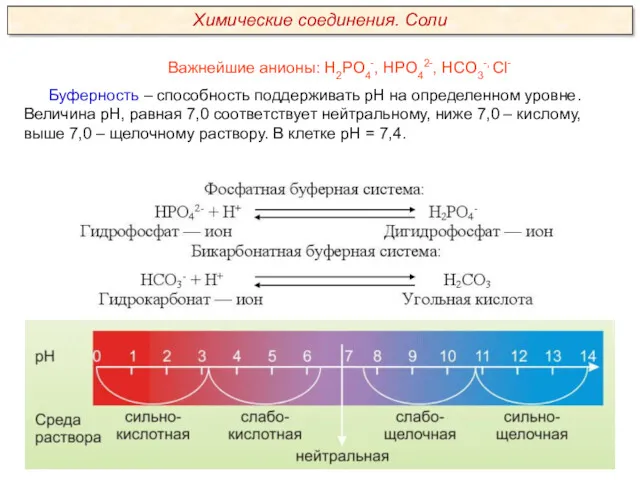

 Качественный анализ. Классификация катионов и анионов. (Лекция 2)
Качественный анализ. Классификация катионов и анионов. (Лекция 2) Жиры. История открытия, строение, классификация, свойства
Жиры. История открытия, строение, классификация, свойства Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін)
Сандық есептер (металдар мен оның қосылыстарындағы генетикалық байланысты көрсететін) Табиғи нанокристалдар
Табиғи нанокристалдар Chemical Formulas and Nomenclature of compounds
Chemical Formulas and Nomenclature of compounds Токсическое действие диоксинов и диоксиноподоных соединений
Токсическое действие диоксинов и диоксиноподоных соединений Классы неорганических соединений
Классы неорганических соединений Розв’язування задач на приготування розчинів із кристалогідратів
Розв’язування задач на приготування розчинів із кристалогідратів Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие
Обратимость химических реакций. Обратимые и необратимые химические реакции. Химическое равновесие Алкани
Алкани Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка
Физико-химические свойства белков. Количественные (колориметрические) методы определения концентрации белка Углекислый газ СО2
Углекислый газ СО2 Нанотехнологии и Наноматериалы
Нанотехнологии и Наноматериалы Углеводороды. Предельные (насыщенные) углеводороды
Углеводороды. Предельные (насыщенные) углеводороды Счастливый случай. Право первого хода
Счастливый случай. Право первого хода Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки
Експлуатаційні матеріали. Пальне для карбюраторних, дизельних двигунів. Змащувальні масла, пластичні мастила військової техніки Получение и свойства кислорода
Получение и свойства кислорода Общие черты гидротермальных месторождений
Общие черты гидротермальных месторождений Азот и фосфор
Азот и фосфор Строение атома. Химия. 11 класс
Строение атома. Химия. 11 класс Строение алканов. Физические и химические свойства алканов. Получение алканов
Строение алканов. Физические и химические свойства алканов. Получение алканов Минералы и их основные морфологические характеристики
Минералы и их основные морфологические характеристики Металлическая связь
Металлическая связь Химические добавки к бетонам
Химические добавки к бетонам Применение солей
Применение солей Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні і ендотермічні реакції. Термохімічні рівняння Аммиак. 9 класс
Аммиак. 9 класс Методические подходы к решению химических задач. Задание 34
Методические подходы к решению химических задач. Задание 34