Содержание
- 2. Модели атома Модель атома Томсона Модель атома Резерфорда Модель атома Бора
- 3. Модель атома Томсона «Пудинг с изюмом» Джозеф Томсон (1856 -1940), английский учёный, в 1897г. открыл электрон,
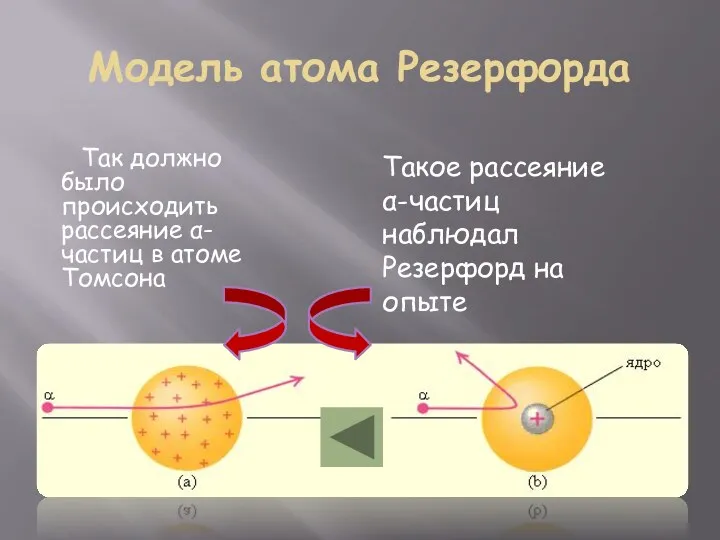
- 4. Модель атома Резерфорда Так должно было происходить рассеяние α-частиц в атоме Томсона Такое рассеяние α-частиц наблюдал
- 5. - Сравнение размеров ядра и электрона Сравните соотношение размеров ядра и электрона в атоме
- 6. Модель атома Бора Построена на основе Планетарной модели Резерфорда, приправленной квантовыми постулатами: 1 постулат: Электрон может
- 7. Корпускулярно-волновые свойства микромира Элементарные частицы имеют ничтожно малые массы и размеры, поэтому обладают особыми свойствами. Квантовая
- 8. Протонно-нейтронная теория В 1932 г была разработана протонно-нейтронная теория строения атомного ядра. Итак: Ядро состоит из
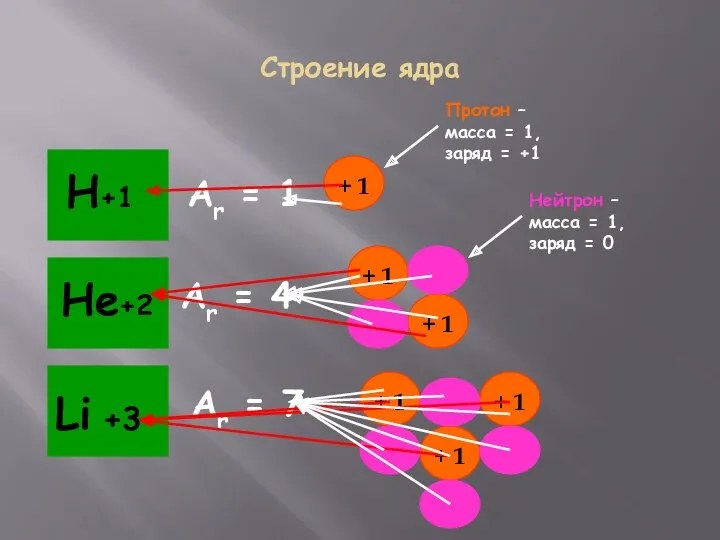
- 9. Строение ядра Аr = 1 Аr = 4 Аr = 7 Протон – масса = 1,
- 10. Что произойдет, если изменится число протонов в ядре? Изменение числа протонов в ядре приведет к образованию
- 11. Что произойдет, если изменится число нейтронов в ядре атома? Изменение числа нейтронов в атоме приведет к
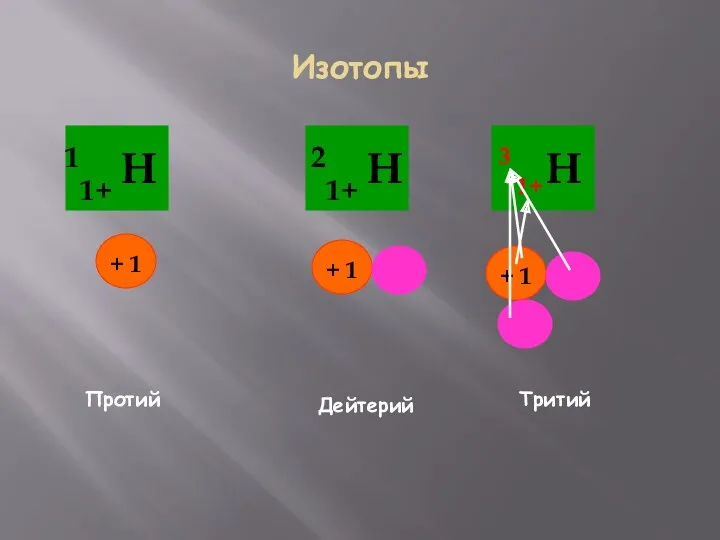
- 12. Изотопы Протий Дейтерий Тритий 1+ 3
- 13. Повторим Какие модели строения атома Вам известны? В чем их несостоятельность? Какие постулаты предложил Н. Бор?
- 14. СОСТОЯНИЕ ЭЛЕКТРОНА В АТОМЕ Квантовые числа. Принципы заполнения электронных оболочек атомов электронами.
- 15. Важнейшие понятия Состояние электрона в атоме - это совокупность информации об энергии определенного электрона и пространстве,
- 16. Электронное облако
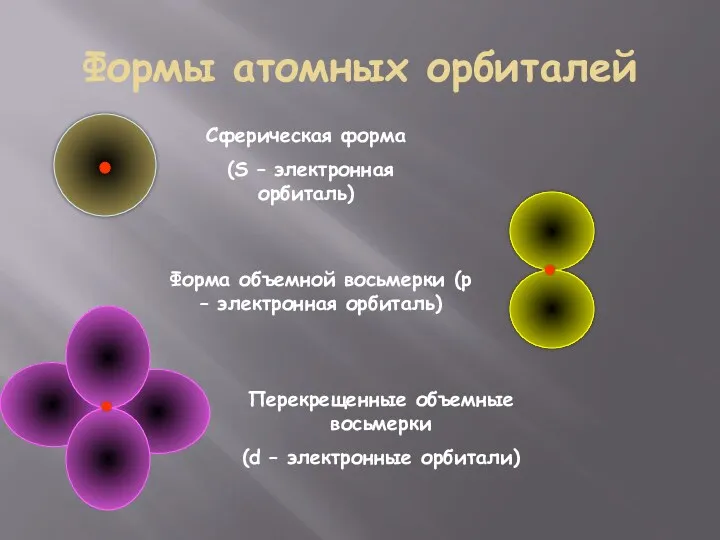
- 17. Формы атомных орбиталей Сферическая форма (S – электронная орбиталь) Форма объемной восьмерки (p – электронная орбиталь)
- 18. Квантовые числа Совокупность сложных движений электрона в атоме характеризуются квантовыми числами. Различают: n – главное квантовое
- 19. Главное квантовое число (n) Характеризует общую энергию электрона данного энергетического уровня. Принимает целые значения: 1,2,3… Главное
- 20. Побочное квантовое число (l) Характеризует запас энергии электрона в пределах энергетического уровня. Принимает значения от 0
- 21. Магнитное квантовое число ml Характеризует распределение орбиталей в магнитном поле ядра. Зависит от побочного квантового числа.
- 22. Магнитное спиновое квантовое число (ms) Это собственный момент импульса электрона. Может принимать значения: -1/2 или +1/2
- 23. Задание Опишите состояние электронов в атоме химического элемента №8, используя все квантовые числа.
- 24. Принципы заполнения электронных оболочек Принцип наименьшей энергии. Принцип Паули. Правило Хунда Правило Клечковского. Задание: Напишите электронную
- 25. Принцип наименьшей энергии Электрон занимает тот энергетический уровень, тот подуровень, ту атомную орбиталь, которым соответствует минимальный
- 26. Принцип Паули В одном и том же атоме не может быть двух электронов, обладающих одинаковым набором
- 27. Правило Хунда Правило Хунда определяет порядок заполнения орбиталей определённого подслоя и формулируется следующим образом: суммарное спиновое
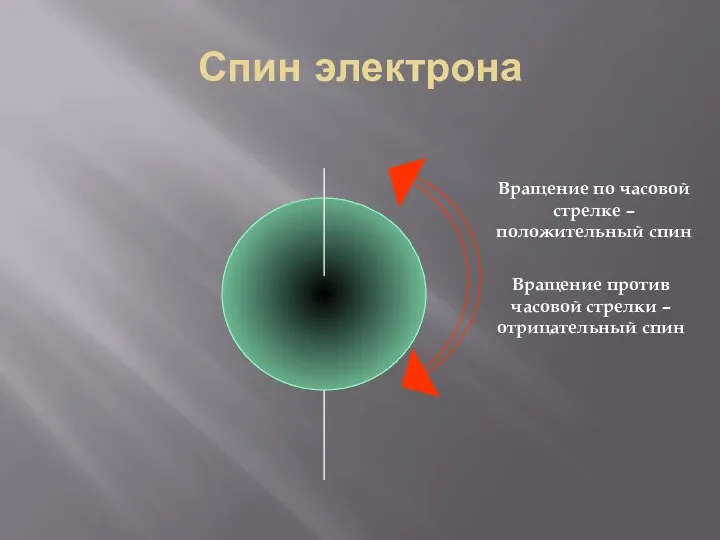
- 28. Спин электрона Вращение по часовой стрелке – положительный спин Вращение против часовой стрелки – отрицательный спин
- 29. Правило Клечковского Заполнение электронами орбиталей в атоме происходит в порядке возрастания суммы главного и орбитального квантового
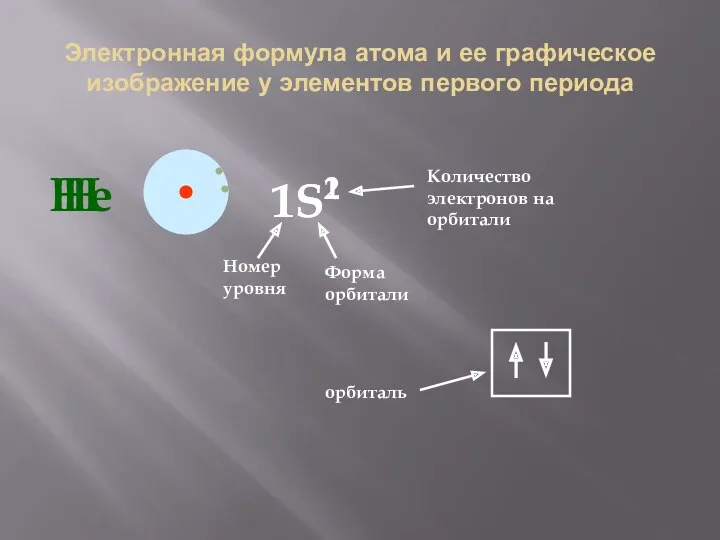
- 30. Электронная формула атома и ее графическое изображение у элементов первого периода Н 1S1 Номер уровня Форма
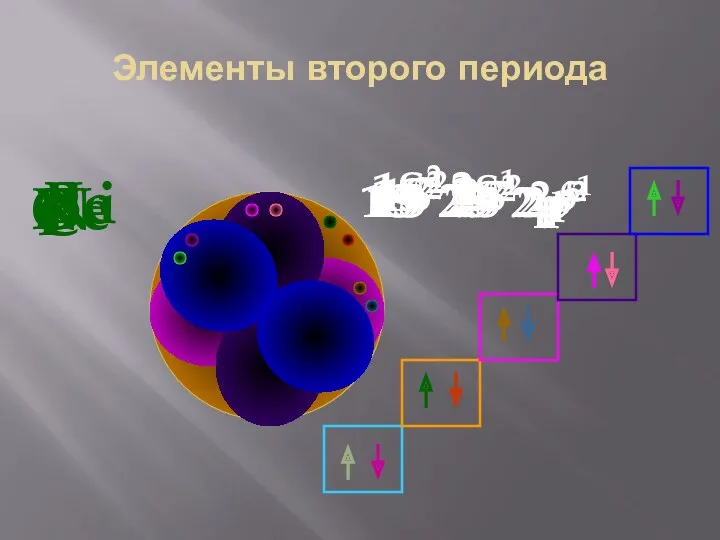
- 31. Элементы второго периода Li 1S2 2S1 Be 1S2 2S2 B 1S2 2S2 2p1 C 1S2 2S2
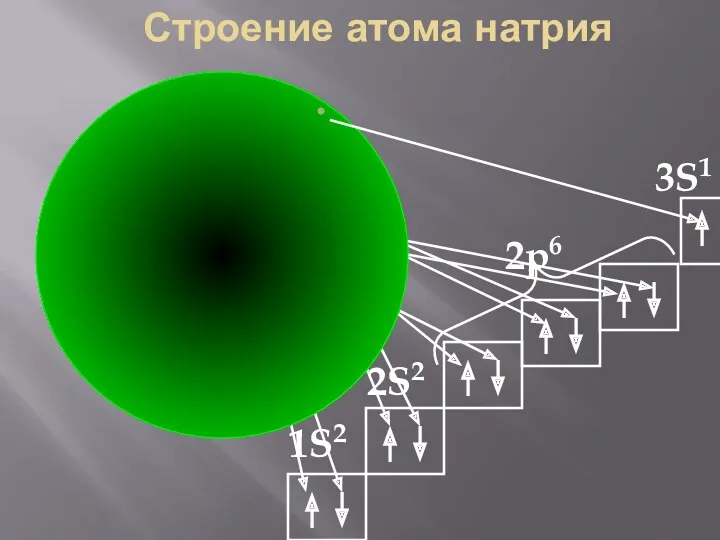
- 32. Na Строение атома натрия 2S2 2p6 3S1 1S2
- 34. Скачать презентацию























 Теория сплавов
Теория сплавов Биосенсорные системы
Биосенсорные системы Соли. Классификация
Соли. Классификация Основи. Склад, назви, класифікація, використання
Основи. Склад, назви, класифікація, використання Водород. Общая характеристика, получение, свойства
Водород. Общая характеристика, получение, свойства Арены. Бензол и его гомологи. Химия. 10 класс
Арены. Бензол и его гомологи. Химия. 10 класс Расчеты по химическим уравнениям. Алгоритм решения расчетных задач
Расчеты по химическим уравнениям. Алгоритм решения расчетных задач Химическая взрывчатка
Химическая взрывчатка Получение галогенов. Биологическое значение и применение галогенов и их соединений
Получение галогенов. Биологическое значение и применение галогенов и их соединений Тағамдық қоспалардың функционалдық жүктелуі және олардың сипаттамасы
Тағамдық қоспалардың функционалдық жүктелуі және олардың сипаттамасы Тест по неорганической химии
Тест по неорганической химии Производство серной кислоты контактным способом
Производство серной кислоты контактным способом Белки. Содержание белков в различных тканях
Белки. Содержание белков в различных тканях Водород. Химические свойства
Водород. Химические свойства Хлор
Хлор Пропилен-алкены(пропен)
Пропилен-алкены(пропен) Аминокислоты. Пептиды. Белки
Аминокислоты. Пептиды. Белки Объемная доля газа в смеси. (Урок 16. 7 класс)
Объемная доля газа в смеси. (Урок 16. 7 класс) Современные тенденции развития химии
Современные тенденции развития химии Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева Незвичайна вода
Незвичайна вода Химия. Викторина
Химия. Викторина Карбоновые кислоты. Свойства карбоновых кислот
Карбоновые кислоты. Свойства карбоновых кислот Соли аммония
Соли аммония Азотная кислота
Азотная кислота Керамические материалы
Керамические материалы Химическая промышленность и химические технологии
Химическая промышленность и химические технологии Задачи
Задачи