Содержание
- 2. Определение солей Со́ли — вещества, состоящие из катионов металла (или катионов аммония NH4 ; известны соли
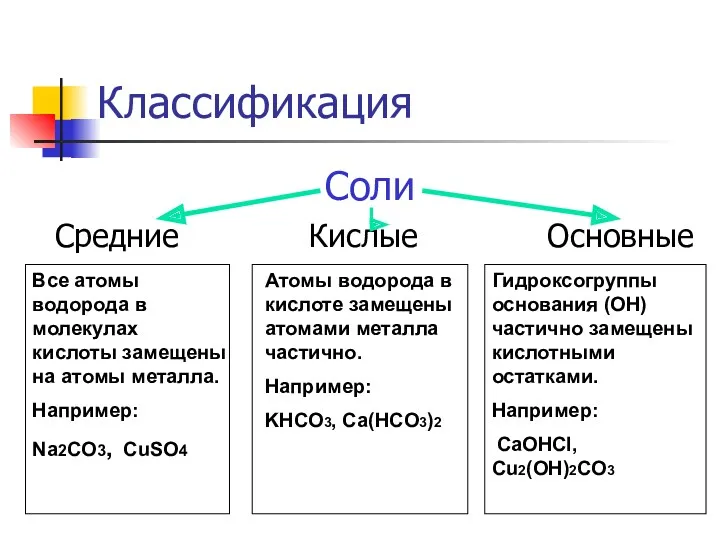
- 3. Классификация Соли Средние Кислые Основные Все атомы водорода в молекулах кислоты замещены на атомы металла. Например:
- 4. Физические свойства солей Как все ионные вещества, соли при н.у. – твердые кристаллы. Окраска зависит от
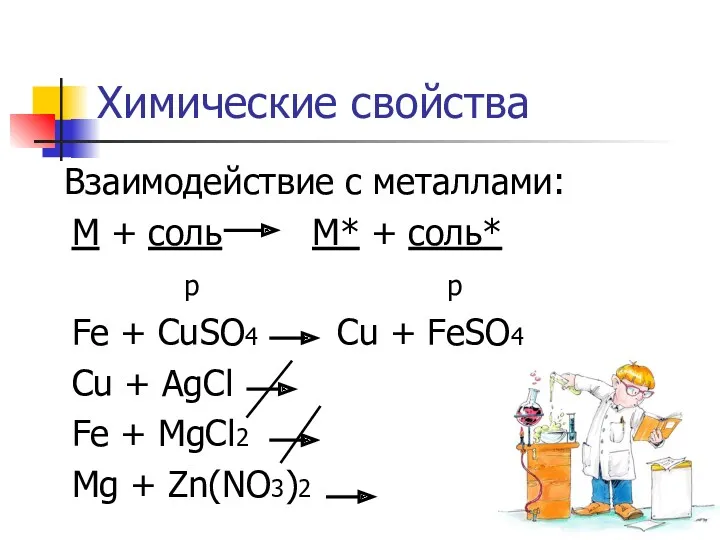
- 5. Химические свойства Взаимодействие с металлами: М + соль М* + соль* р р Fe + CuSO4
- 6. Химические свойства Взаимодействие со щелочами: NaOH + CuSO4 KOH + AgCl NaOH + K2CO3 Взаимодействие с
- 7. Химические свойства Взаимодействие солей друг с другом: соль1 + соль2 = соль3 + соль4 Р Р
- 8. Химические свойства Некоторые соли разлагаются при нагревании:
- 9. Химические свойства Взаимодействие с водой: CuSO4 + 5H2O CuSO4 5H2O Al2S3 + 6H2O 2Al(OH)3 + 3H2S
- 10. Соли в природе Многие минералы — соли, образующие залежи (например, галит NaCl, сильвин KCl, флюорит CaF2).
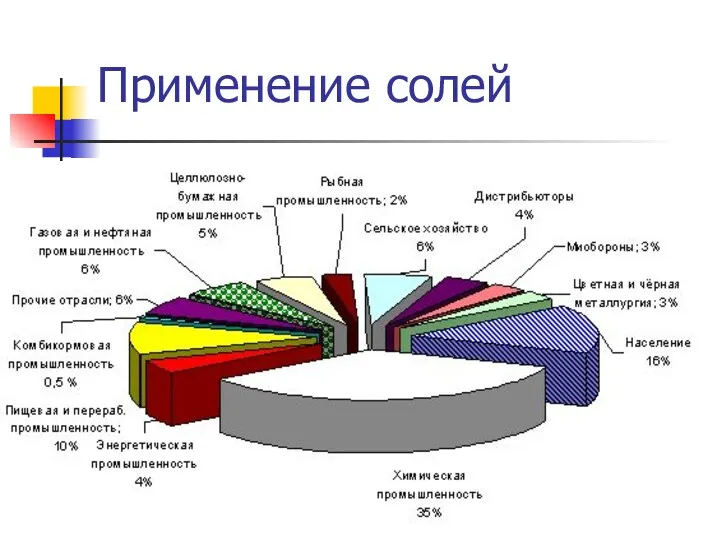
- 12. Применение солей
- 13. Общие способы синтеза солей 1.Получение средних солей: 1) металла с неметаллом: 2Na + Cl2 = 2NaCl
- 14. 6) основания с кислотным оксидом Ba(OH)2+ CO2 = BaCO3 + H2O 7) основания с кислотой: Ca(OH)2
- 15. 2.Получение кислых солей: 1. Взаимодействие кислоты с недостатком основания. KOH + H2SO4 = KHSO4 + H2O
- 16. 3.Получение основных солей: 1. Добавление (по каплям) небольших количеств щелочей к растворам средних солей металлов AlCl3
- 17. Гидролиз солей Некоторые соли в водном растворе способны подвергаться гидролизу. Данная реакция протекает обратимо для солей
- 19. Скачать презентацию













 Массовая доля растворенного вещества в растворе
Массовая доля растворенного вещества в растворе Способы производства железоуглеродистых сплавов
Способы производства железоуглеродистых сплавов Суспензии: получение, свойства
Суспензии: получение, свойства Соли (12 класс)
Соли (12 класс) Фенолы. Классификация фенолов
Фенолы. Классификация фенолов Химические опасности. Нитраты
Химические опасности. Нитраты Lipid metabolism
Lipid metabolism Контроль результатов обучения химии
Контроль результатов обучения химии Галогены. Строение атомов и молекул галогенов
Галогены. Строение атомов и молекул галогенов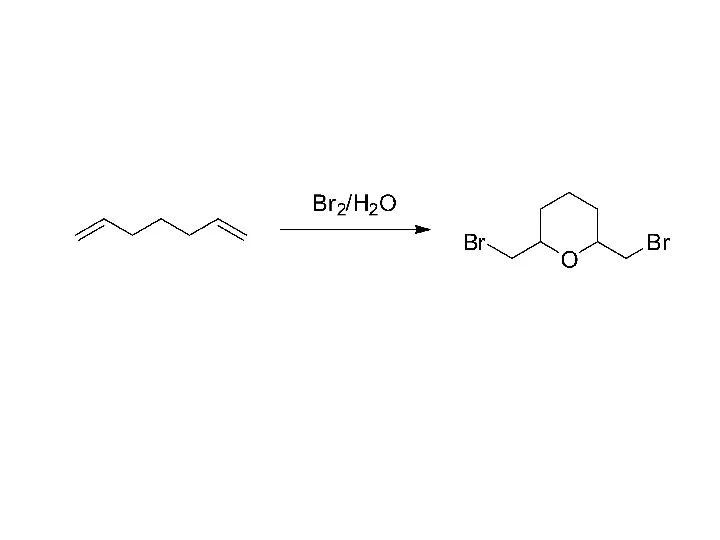 Превращение (S)-бутанол-2 в другие соединения
Превращение (S)-бутанол-2 в другие соединения Три состояния вещества
Три состояния вещества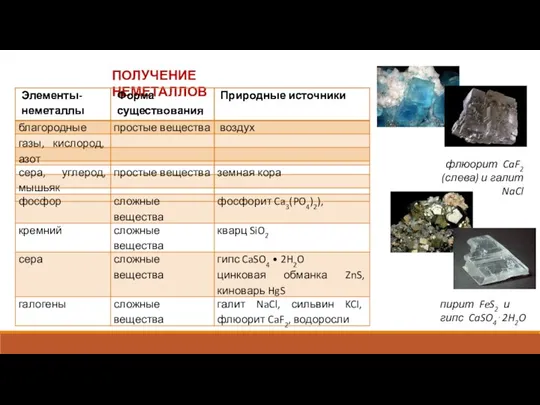 Получение неметаллов
Получение неметаллов Липолиз. Обмен кетоновых тел
Липолиз. Обмен кетоновых тел Алюминий. Определите элемент
Алюминий. Определите элемент Оксид кальция (СаО)
Оксид кальция (СаО) Chemical reactions and heat. (Chapter 1)
Chemical reactions and heat. (Chapter 1) Натрий алкилсульфонаттарын алу. №4 лекция
Натрий алкилсульфонаттарын алу. №4 лекция Растворы. Основные понятия и определения
Растворы. Основные понятия и определения Игра - викторина
Игра - викторина Лекция 2 Периодический закон
Лекция 2 Периодический закон Techniques for preparation of gaseous samples with a desired concentration of analyte
Techniques for preparation of gaseous samples with a desired concentration of analyte Химия в повседневной жизни человека
Химия в повседневной жизни человека Предмет органической химии
Предмет органической химии Полимеры, их классификации и способы получения
Полимеры, их классификации и способы получения Атом құрылысы
Атом құрылысы Химический элемент - водород
Химический элемент - водород Plastic is one of the challenges of the 21st century
Plastic is one of the challenges of the 21st century Періодична система хімічних елементів
Періодична система хімічних елементів