Содержание
- 2. Основные понятия и определения Грубодисперсные системы Суспензии Эмульсии Аэрозоли
- 3. Основные понятия и определения Коллоидные растворы Растворы– однофазные системы переменного состава, состоящие из 2 или более
- 4. Теории растворов Физическая теория (Вант-Гофф, Аррениус) – Химическая теория (Менделеев, Каблуков)
- 5. Современная теория объединяет обе теории. Растворы обладают переменностью состава К р-рам не применимы стехиом. законы Р-ры
- 6. Сольватная теория Процесс растворения состоит из 3 стадий Фазовый переход – разрушение кристал. решетки
- 7. Сольватная теория Сольватация ионов Диффузия сольватов
- 8. Растворимость Растворимость – способность в-ва раст-ся в опред. кол-ве раств-ля. Мерой раств-ти крист. в-ва явл-ся конц.
- 9. Растворимость На растворимость влияют: 1. Природа компонентов 1) «Подобное раствор-ся в подобном» 2) Н-связи (неограниченно раст-мы
- 10. Растворимость 2. Температура
- 11. 3. Влияние давления Ув-ние Р приводит к росту раст-сти газов. Закон Генри: раст-сть газа при постоянной
- 12. Свойства растворов неэлектролитов Идеальный раствор – Образ-ие идеального р-ра не сопровождается объемными и тепловыми эффектами.
- 13. Коллигативные свойства растворов Коллиг-ные св-ва – 1. Давление насыщенного пара р-ля над р-ром 2. Температура кипения
- 14. Давление насыщенного пара растворителя над раствором (Первый закон Рауля) жидкость ⮀ пар Растворение в-ва в жидкости
- 15. Первый закон Рауля Обозначим: Pо – давление насыщенного пара р-ля над чистым р-лем; P1о - давление
- 16. Первый закон Рауля P1о = Pо ⋅ Х1
- 17. Первый закон Рауля давление насыщенного пара р-ля над р-ром равно его давлению над чистым р-лем, умноженному
- 18. Первый закон Рауля относительное понижение Р насыщенного пара р-ля над р-ром = мольной доле раст-ного в-ва.
- 19. Температура кипения и замерзания раствора. Второй закон Рауля Tкип. – Tзам. ––
- 20. Температура кипения и замерзания раствора. Второй закон Рауля Повышение tкип р-ра и понижение его tзам прямо
- 21. Осмос Осмотическое давление – это такое Р, которое нужно приложить, чтобы подавить осмос. Вант-Гофф: Pосм. =
- 22. Растворы электролитов Электролиты – это в-ва, способные диссоциировать в р-рах или расплавах на ионы. Доказательство 1.
- 23. Теория электролитической диссоциации Аррениуса (ТЭД) Основные положения ТЭД 1. Электролиты в растворах диссоциируют на ионы. 2.
- 24. Колличественные характеристики процесса диссоциации Константа диссоциации. КД =
- 25. Колличественные характеристики процесса диссоциации Степень диссоциации – это отношение числа диссоциированных молекул к общему числу молекул:
- 26. Колличественные характеристики процесса диссоциации α α > 30% - сильный 3% ≤ α ≤ 30% -
- 27. Связь степени дис-ции с изотоническим коэф-том
- 28. Закон разбавления Оствальда Для слабых электролитов α → 0, а (1 - α) →1 Отсюда: α
- 29. Факторы, влияющие на степень диссоциации α зависит от конц-ции р-ра. α зависит от T. 3. α
- 31. Скачать презентацию




























 Алкадиены
Алкадиены Химиялық қауіптілер. Нитраттар
Химиялық қауіптілер. Нитраттар Неорганические полимеры
Неорганические полимеры Камни и Телец
Камни и Телец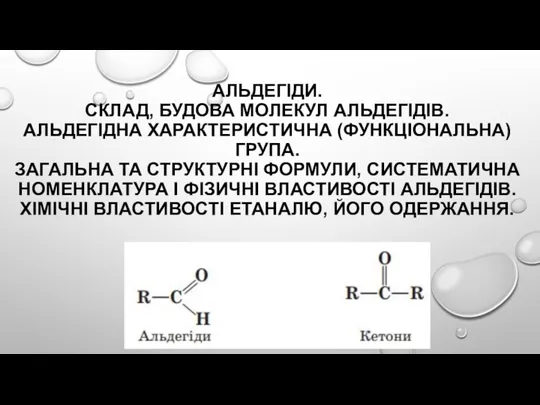 Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група
Альдегіди. Склад, будова молекул альдегідів. Альдегідна характеристична (функціональна) група Металдар коррозиясы және онымен күресу шаралары
Металдар коррозиясы және онымен күресу шаралары Введение в токсикологическую химию. Объекты химико-токсикологического исследования
Введение в токсикологическую химию. Объекты химико-токсикологического исследования Скорость химической реакции
Скорость химической реакции Азотные удобрения
Азотные удобрения Кислоты. Состав кислот
Кислоты. Состав кислот Значення хімічних процесів у природі
Значення хімічних процесів у природі Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Чистые вещества и смеси. 8 класс
Чистые вещества и смеси. 8 класс Теплові прояви механічної, електричної та хімічної енергії
Теплові прояви механічної, електричної та хімічної енергії Железо и его соединения
Железо и его соединения Гигиена труда при работе с пестицидами и минеральными удобрениями
Гигиена труда при работе с пестицидами и минеральными удобрениями Химическое равновесие. Азот и Фосфор. 9 класс
Химическое равновесие. Азот и Фосфор. 9 класс Історія хімії
Історія хімії Магний. Нахождение в природе
Магний. Нахождение в природе Железо. Строение атома, физические и химические свойства простого вещества
Железо. Строение атома, физические и химические свойства простого вещества Основы коррозии и защиты металлов. Опасность локальных видов коррозии
Основы коррозии и защиты металлов. Опасность локальных видов коррозии Обзор уникальных свойств и областей применения магнитных жидкостей. Получение ферромагнитной жидкости
Обзор уникальных свойств и областей применения магнитных жидкостей. Получение ферромагнитной жидкости Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота
Анализ лекарственных средств паминофенола, ароматических кислот: бензойная кислота, натрия бензоат, салициловая кислота Минерал чароит. Месторождения
Минерал чароит. Месторождения Основные физико-химические свойства нефтей и нефтепродуктов
Основные физико-химические свойства нефтей и нефтепродуктов Элементы химической термодинамики
Элементы химической термодинамики Свойства растворов и гетерогенных систем
Свойства растворов и гетерогенных систем Алюминий AL- химический элемент
Алюминий AL- химический элемент