Содержание
- 2. Железо и его соединения Урок-проект в 9 классе подготовила Яскевич В.А. учитель химии МОУ «Кадетская школа
- 3. План изучения вещества Железо как химический элемент. Нахождение в природе. Получение. Физические свойства железа. Химические свойства
- 4. Визитная карточка железа Порядковый номер Период Группа Подгруппа Ar 26 4 VIII Побочная 56
- 5. Строение атома железа 2е; 8е; 14е; 2е. 1s2 2s2 2р6 3s2 3р6 3d6 4s2 26 p;
- 6. Степени окисления Для железа характерны две основные степени окисления: +2, +3. Fe0 –2e = Fe+2 Fe0
- 7. Распространенность в природе 4-е место среди элементов после O, Si, Al. 2-е место по количеству в
- 8. Железо – простое вещество Физические свойства железа Цвет Блеск Пластичность Магнитные свойства Температура плавления Твердость Серебристо-белый
- 9. Нахождение в природе Fe3O4 – магнитный железняк (72%) Fe2O3 – красный железняк (гематит) (65%) 2Fe2O3 *
- 10. Способы получения Домны. Кислородный конвертер. Генри Бессемер Электродуговые печи. Пьер Мартен
- 11. Биологическая роль железа В организме человека содержится около 5 г железа. Из них 57% приходится на
- 12. Биологическая роль железа Суточная норма потребности человека составляет около 15 мг железа. Много железа в сливовом
- 13. Химические свойства 1. Железо реагирует с неметаллами: 2 Fe+3Cl2 = 2FeCl3 Fe+S = FeS 3 Fe+
- 14. Генетические ряды железа Fe ? FeCl2 ? Fe(OH)2 ? FeO Fe ? FeCl3 ? Fe(OH)3 ?
- 15. Сплавы железа Сталь Чугун
- 16. Применение железа и его соединений Железный купорос, хлорное железо, оксиды железа используют для приготовления лекарств, катализаторов,
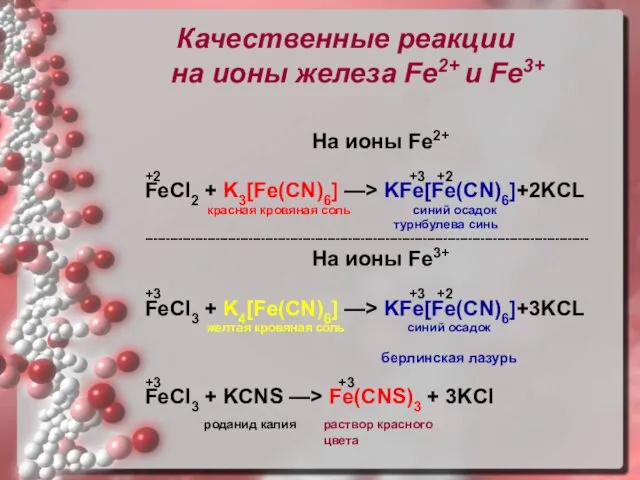
- 17. Качественные реакции на ионы железа Fe2+ и Fe3+ На ионы Fe2+ +2 +3 +2 FeCl2 +
- 18. Качественные реакции на ионы железа Fe2+ и Fe3+ Качественная реакция на ионы железа Fe2+: реактив –
- 19. «Определение содержания Fe3+ в воде, взятой из различных источников» Материалы: проб воды, взятые в разных местах,
- 20. Вывод Железо – жизненно необходимый элемент для всех живых организмов Железо – металл без которого невозможен
- 21. Железо не только основа всего мира, самый главный металл окружающей нас природы, оно – основа культуры
- 23. Скачать презентацию



















 Строение и химические свойства кислот
Строение и химические свойства кислот Неомыляемые липиды. Изопреноиды
Неомыляемые липиды. Изопреноиды Хімічний зв’язок. Типи хімічного зв’язку
Хімічний зв’язок. Типи хімічного зв’язку Электролитическая диссоциация. 9 класс
Электролитическая диссоциация. 9 класс Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота Electrolysis
Electrolysis Массовая доля вещества в растворе
Массовая доля вещества в растворе Химический состав нефти
Химический состав нефти Склад і властивості нафти
Склад і властивості нафти Алкины. Гомологический ряд
Алкины. Гомологический ряд Эксплуатационные материалы
Эксплуатационные материалы Алкины
Алкины Каучук. Немного из истории
Каучук. Немного из истории Задачі на визначення ступеню електролітичної дисоціації
Задачі на визначення ступеню електролітичної дисоціації Матеріальний баланс процесу горіння. Основні поняття матеріального балансу горіння
Матеріальний баланс процесу горіння. Основні поняття матеріального балансу горіння Лекция по химии
Лекция по химии Сучасні каталізатори у процесах нафтопереробки та нафтохімії
Сучасні каталізатори у процесах нафтопереробки та нафтохімії Нанопористые материалы
Нанопористые материалы Зерттеу әдістері
Зерттеу әдістері Хімічні формули речовин. Урок №14
Хімічні формули речовин. Урок №14 Химические реакции. Реакции разложения
Химические реакции. Реакции разложения Круговорот воды в природе
Круговорот воды в природе Ароматические углеводороды (арены)
Ароматические углеводороды (арены) Обмен нуклеопротеинов
Обмен нуклеопротеинов Неметаллы. Особенности строения атомов неметаллов
Неметаллы. Особенности строения атомов неметаллов Азотная кислота
Азотная кислота Активные формы кислорода. Антиоксиданты их физиологическая роль
Активные формы кислорода. Антиоксиданты их физиологическая роль Углепластики
Углепластики