Содержание
- 2. Цели урока: Повторить особенности строения атомов неметаллов и ковалентную неполярную связь Познакомиться с физическими свойствами неметаллов
- 3. Содержание: Положение неметаллов в Периодической системе Д.И.Менделеева Особенности строения атомов неметаллов Ковалентная неполярная связь Физические свойства
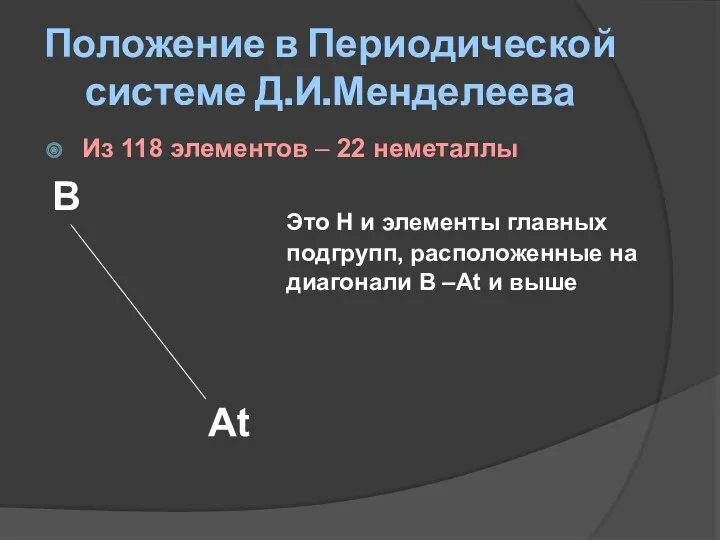
- 4. Положение в Периодической системе Д.И.Менделеева Из 118 элементов – 22 неметаллы B Это Н и элементы
- 5. Особенности строения атомов неметаллов меньший Ra и большее число е на внешнем уровне (по сравнению с
- 6. Химическая связь в простых веществах неметаллах Ковалентная неполярная – образуется за счёт объединения валентных электронов между
- 7. Простые вещества неметаллы
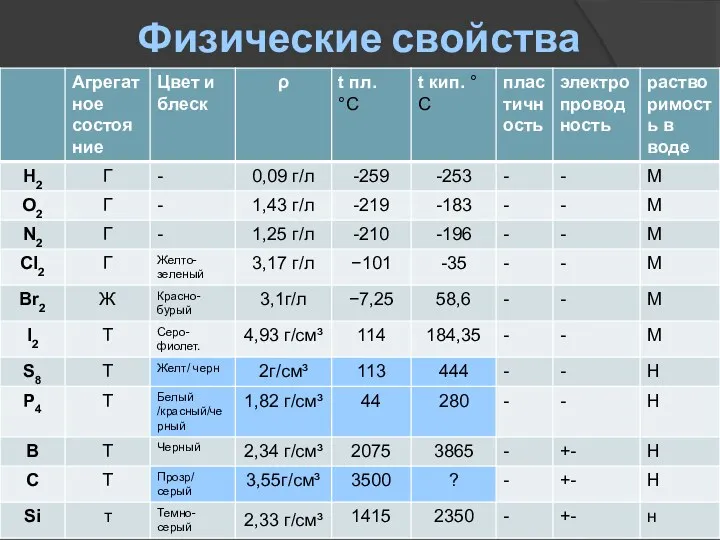
- 8. Физические свойства
- 9. Кристаллические решётки молекулярные H2, O2, N2, F2, Cl2, Br2, I2, P4, S8 - непрочные, легкоплавкие, малорастворимые,
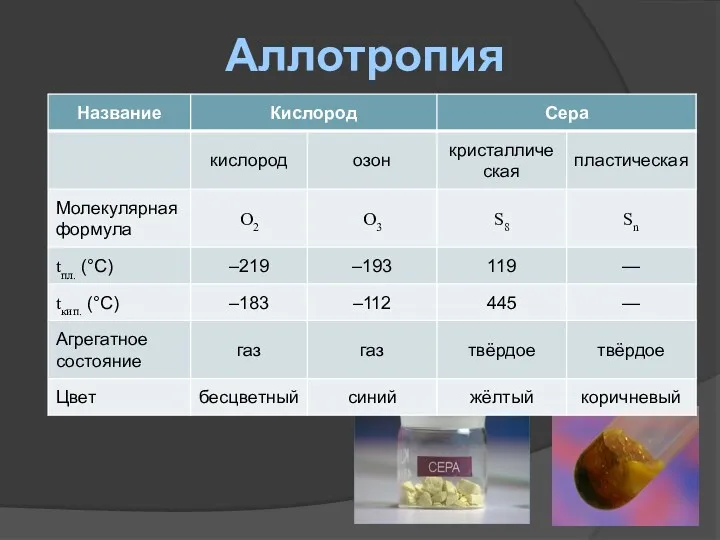
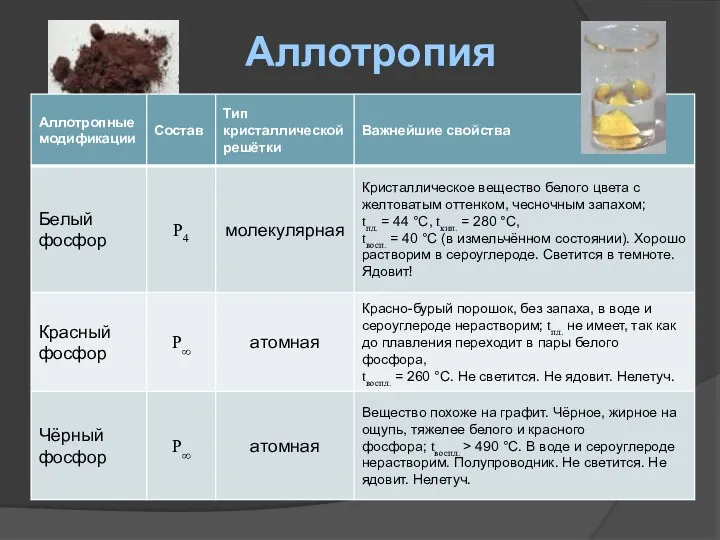
- 10. Аллотропия
- 11. Аллотропия
- 12. Аллотропия
- 13. Аллотропия Аллотропия (от греч. állos — «другой» и trópos — «поворот, свойство») — существование одного и
- 14. Химические свойства Окислительные свойства (в реакциях с металлами и менее электроотрицательными неметаллами) Восстановительные свойства (в реакциях
- 15. Окислительные свойства …Na + Cl2 =…NaCl …Al + …Cl2 =…AlCl3 …Mg + O2 =…MgO Fe +
- 16. Восстановительные свойства N2 + O2 =…NO …P + …O2 =…P2O5 C + O2 = CO2 WO3
- 17. Домашнее задание §10 + конспект
- 19. Скачать презентацию












 Особенности применения проблемных моделей обучения на уроках химии
Особенности применения проблемных моделей обучения на уроках химии Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6
Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6 Алюминий и его соединения
Алюминий и его соединения Расчет материального и теплового баланса процесса пиролиза гексана
Расчет материального и теплового баланса процесса пиролиза гексана Неоднородные системы (процессы и аппараты химической технологии, 8 лекция)
Неоднородные системы (процессы и аппараты химической технологии, 8 лекция) Предмет аналитической химии и ее основные понятия
Предмет аналитической химии и ее основные понятия Алкадиены. Диеновые углеводороды
Алкадиены. Диеновые углеводороды Изомерия. Типы изомерии
Изомерия. Типы изомерии Химические уравнения
Химические уравнения α-Аминокислоты и белки
α-Аминокислоты и белки Відносна густина газів
Відносна густина газів Циклоалканы
Циклоалканы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Щелочной металл натрий
Щелочной металл натрий Гидролиз. Необратимый гидролиз
Гидролиз. Необратимый гидролиз Химическая промышленность
Химическая промышленность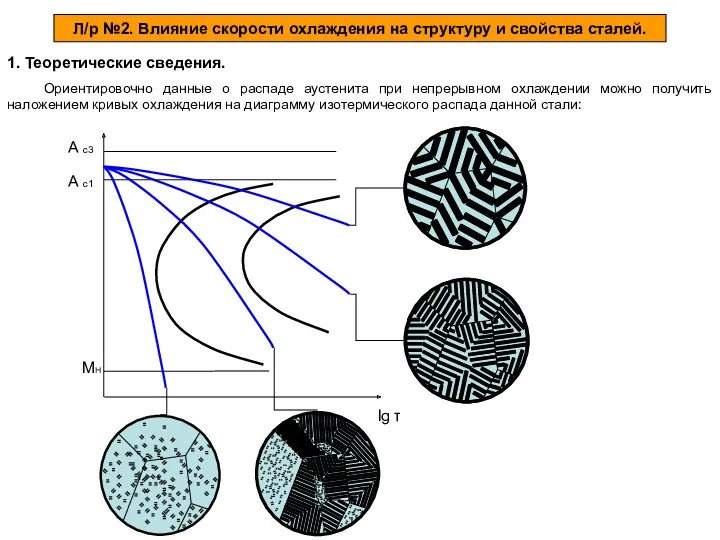 Влияние скорости охлаждения на структуру и свойства сталей
Влияние скорости охлаждения на структуру и свойства сталей Органический полимер полиэфирэфиркетон (PEEK). Использование PEEK в 3D-печати
Органический полимер полиэфирэфиркетон (PEEK). Использование PEEK в 3D-печати Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3)
Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3) Алотропні форми Карбону
Алотропні форми Карбону Анализ галогенидов щелочных металлов
Анализ галогенидов щелочных металлов Классификация и номенклатура липидов. Жирные кислоты, их классификация и номенклатура
Классификация и номенклатура липидов. Жирные кислоты, их классификация и номенклатура Окислительно-восстановительные реакции. 11 класс
Окислительно-восстановительные реакции. 11 класс Химический элемент водород
Химический элемент водород СВОЙСТВА ЧЕРНЫХ И ЦВЕТНЫХ МЕТАЛЛОВ.
СВОЙСТВА ЧЕРНЫХ И ЦВЕТНЫХ МЕТАЛЛОВ. Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3
Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3 Хром. Строение атома
Хром. Строение атома Особенности химического состава клетки
Особенности химического состава клетки