Содержание
- 2. Рекомендуемая литература Крешков А.П. Основы аналитической химии (в 3-х томах) Аналитическая химия. Под ред. Ю.А. Золотова
- 3. 1.1 Предмет аналитической химии Анализ и синтез Аналитическая химия – наука о методах качественного и количественного
- 4. Задачи аналитической химии: Развитие теоретических основ методов анализа; Усовершенствование методов анализа; Разработка новых методов анализа. Роль
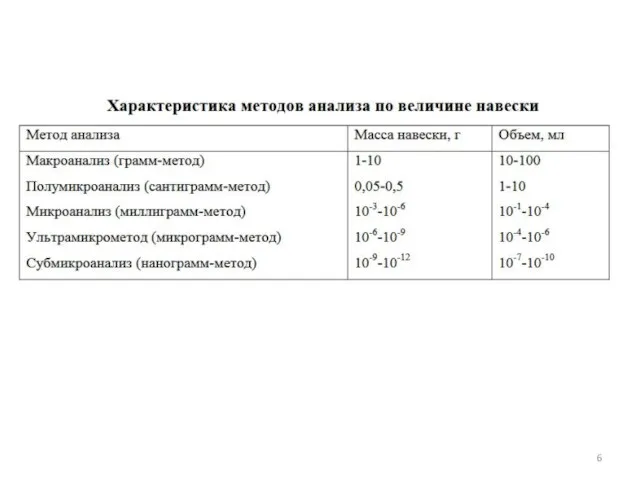
- 5. 1.2 Классификация методов анализа химического состава Качественный и количественный Элементный, функциональный, молекулярный и фазовый Компоненты: -
- 7. Сухой и мокрый Валовой и локальный Деструктивный и недеструктивный Контактный и дистанционный Дискретный и непрерывный
- 8. Состав вещества определяется по его свойствам Свойства: - интенсивные (характерный спектр испускания или поглощения, длина волны
- 10. Основаны на измерении оптических свойств и различных эффектов, наблюдаемых при взаимодействии вещества с электромагнитным излучением Классификация
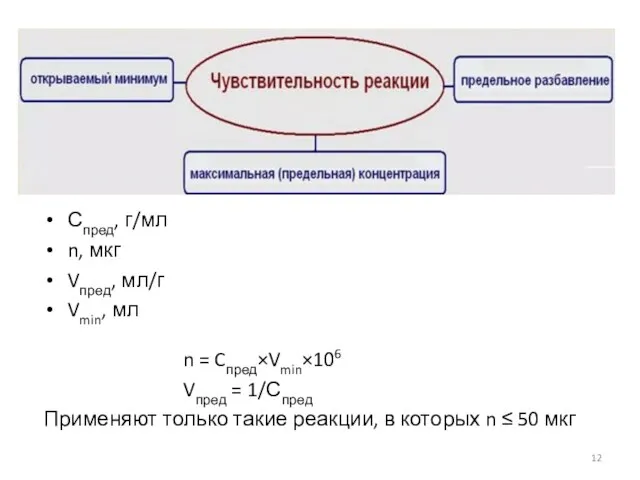
- 11. 1.3 Качественная реакция и ее параметры Качественные реакции – это химические превращения, которые сопровождаются характерными признаками,
- 12. Спред, г/мл n, мкг Vпред, мл/г Vmin, мл n = Cпред×Vmin×106 Vпред = 1/Спред Применяют только
- 13. Требования, предъявляемые к качественной реакции Высокая скорость или быстрое установление равновесия Необратимость Внешний признак Высокая чувствительность
- 14. 1.4 Методы маскирования, разделения и концентрирования Маскирование – это перевод мешающих компонентов в такую форму, которая
- 15. Разделение и концентрирование Разделение – это операция (процесс), в результате которой компоненты, составляющие исходную смесь, отделяются
- 16. Отличие: При разделении концентрации компонентов могут быть близки, а могут и сильно различаться При концентрировании концентрации
- 17. Методы: испарение: упаривание и выпаривание (досуха); озоление - анализируемый материал путем термической обработки на воздухе превращается
- 18. 1.5 Системы качественного анализа Реагенты: 1) Специфические - дают характерную реакцию только с одним ионом и
- 19. Дробный анализ - обнаружение иона или вещества в анализируемой пробе с помощью специфического реагента в присутствии
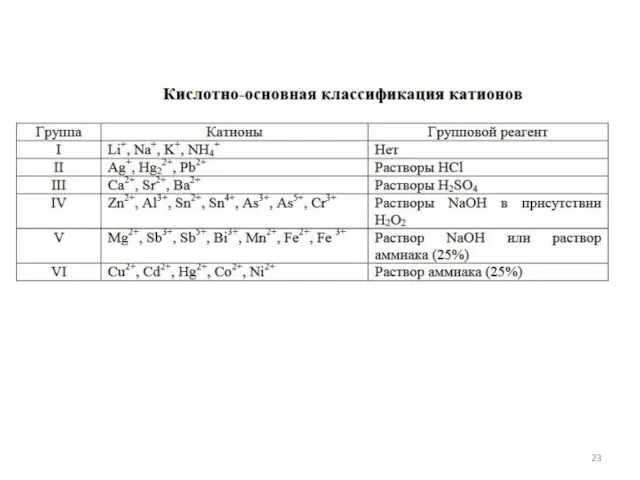
- 20. Классификации катионов по группам сероводородная (сульфидная) аммиачно-фосфатная (или фосфатно-аммиачная) кислотно-основная
- 24. Группы анионов
- 26. Скачать презентацию




















 Геохимия природных процессов
Геохимия природных процессов Химическая термодинамика. Термохимия
Химическая термодинамика. Термохимия Энергетика химических процессов. Химическая термодинамика
Энергетика химических процессов. Химическая термодинамика Алканы
Алканы Способы раскисления и модифицирования стали
Способы раскисления и модифицирования стали Ионоселективные электроды
Ионоселективные электроды План характеристики елемента за його положенням у періодичній системі та будовою атома
План характеристики елемента за його положенням у періодичній системі та будовою атома Строение атома и периодическая система Д.И. Менделеева
Строение атома и периодическая система Д.И. Менделеева Полисахариды. Крахмал
Полисахариды. Крахмал Аналітична хімія. Лекція 1
Аналітична хімія. Лекція 1 Начала органической химии
Начала органической химии Оксиды. Химические свойства оксидов
Оксиды. Химические свойства оксидов Общая характеристика элементов V-А-группы. Азот
Общая характеристика элементов V-А-группы. Азот Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6)
Применение закона действующих масс к окислительно-восстановительным равновесиям. (Лекция 6) Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс
Урок химии по теме Бериллий, магний и щелочноземельные металлы,9 класс Химические и физические свойства кремния
Химические и физические свойства кремния Пластмаси, синтетичні каучуки, гума, штучні й синтетичні
Пластмаси, синтетичні каучуки, гума, штучні й синтетичні Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали
Будова та властивості твердих тіл. Анізотропія кристалів. Рідкі кристали Исследование процесса диффузии на примере движения частиц в жидкостях и газах
Исследование процесса диффузии на примере движения частиц в жидкостях и газах Минералы. Свойства минералов
Минералы. Свойства минералов Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов
Размерные эффекты. Причины и различные проявления размерных эффектов. Определение размерных эффектов Побочная подгруппа VI группы периодической системы
Побочная подгруппа VI группы периодической системы Обчислення за хімічними рівняннями відносного виходу продукту реакції (11 клас)
Обчислення за хімічними рівняннями відносного виходу продукту реакції (11 клас) Электрометрические методы анализа ЛВ. Термографические методы
Электрометрические методы анализа ЛВ. Термографические методы Способы выражения концентрации растворов
Способы выражения концентрации растворов Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром
Синтетические методы получения лекарственных средств гетероциклического ряда антибиотики с четырехчленным азетидиновым ядром Алкадиены (диены)
Алкадиены (диены) Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки