Содержание
- 2. Раствор, в котором данное вещество при данной температуре больше не растворяется, называется насыщенным. Раствор, в котором
- 3. Растворимость вещества (коэффициент растворимости) S - максимальная масса вещества, способная раствориться в 100 г воды при
- 4. Массовая доля вещества в растворе. Если в определенном объеме раствора содержится мало растворенного вещества, то такой
- 5. Wв-ва показывает сколько грамм вещества содержится в 100 граммах раствора: W(NaCl) =30% => в 100г раствора
- 6. Wв-ва показывает сколько грамм вещества содержится в 100 граммах раствора: W(NaCl) =30% => в 100г раствора
- 7. Для приготовления раствора взяли 15г соли и 235г воды. Определить концентрацию раствора (массовую долю вещества в
- 8. Приготовить 300г 15% раствора вещества. Приготовить раствор – значит найти массу вещества и массу растворителя. Дано:
- 9. Растворимость KNO3при 20oС равна 25 г в 100 г воды. Определить концентрацию раствора (массовую долю вещества
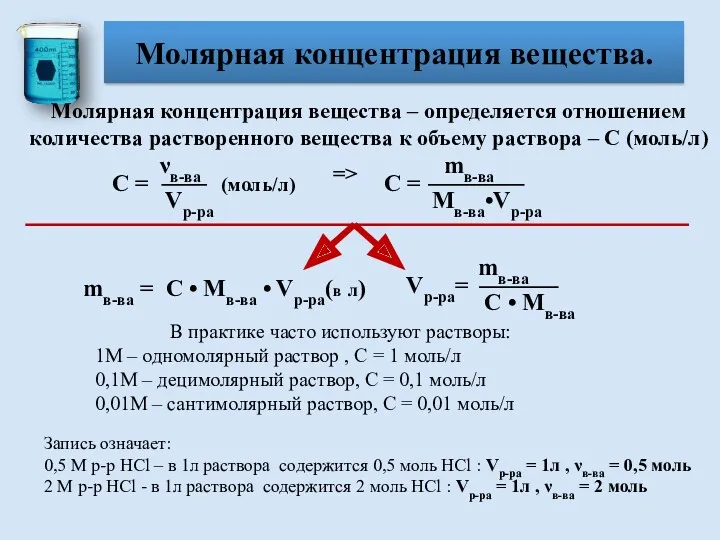
- 10. Молярная концентрация вещества – определяется отношением количества растворенного вещества к объему раствора – С (моль/л) Молярная
- 11. Молярная концентрация вещества связана с массовой долей растворенного вещества соотношением: Молярная концентрация вещества. Wв-ва• ρ р-ра•
- 12. Приготовить 250мл 2М раствора азотной кислоты ( ρ = 0,66 г/мл) Молярная концентрация вещества. Дано: Решение:
- 14. Скачать презентацию










 Строение атома. Лекция 2
Строение атома. Лекция 2 Гетерофункциональные соединения
Гетерофункциональные соединения Ионная связь
Ионная связь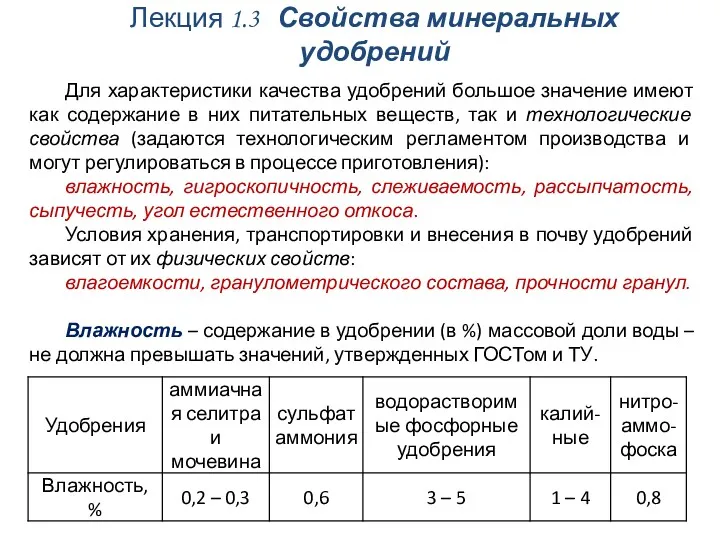 Свойства минеральных удобрений
Свойства минеральных удобрений Химическая кинетика
Химическая кинетика Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Основные постулаты квантовой механики
Основные постулаты квантовой механики Гидролиз солей
Гидролиз солей Physical chemistry of nanostructured systems
Physical chemistry of nanostructured systems Природный газ и нефть
Природный газ и нефть Соединения железа
Соединения железа Периодический закон и периодическая система Д.И. Менделеева. 9 класс
Периодический закон и периодическая система Д.И. Менделеева. 9 класс Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для
Совместимость электродных материалов в новой электрохимической системе Li4Ti5O12/Li3V2(PO4)3 с традиционным электролитом для Предельные углеводороды. (9 класс)
Предельные углеводороды. (9 класс) Типы химических реакций
Типы химических реакций Амины. Анилин
Амины. Анилин Оксид кремния
Оксид кремния Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Третья группа, главная подгруппа. 9 класс
Третья группа, главная подгруппа. 9 класс Азотная кислота
Азотная кислота Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Физические и химические явления
Физические и химические явления Классификация химических реакций
Классификация химических реакций Полисахариды. Крахмал и целлюлоза
Полисахариды. Крахмал и целлюлоза Жескость воды
Жескость воды Защитно-декоративные покрытия
Защитно-декоративные покрытия Чистые вещества и смеси. Растворы
Чистые вещества и смеси. Растворы Химический элемент V группы: сурьма
Химический элемент V группы: сурьма