Содержание
- 2. Чистые вещества и смеси. Растворы. 11 класс база 12.11.18
- 3. Цели урока: Выяснить, какое вещество считают чистым. Что такое смесь? Какие бывают смеси? Вспомнить о растворах?
- 4. Чистые вещества – это вещества, не содержащие примесей других веществ. В природе нет практически чистых веществ
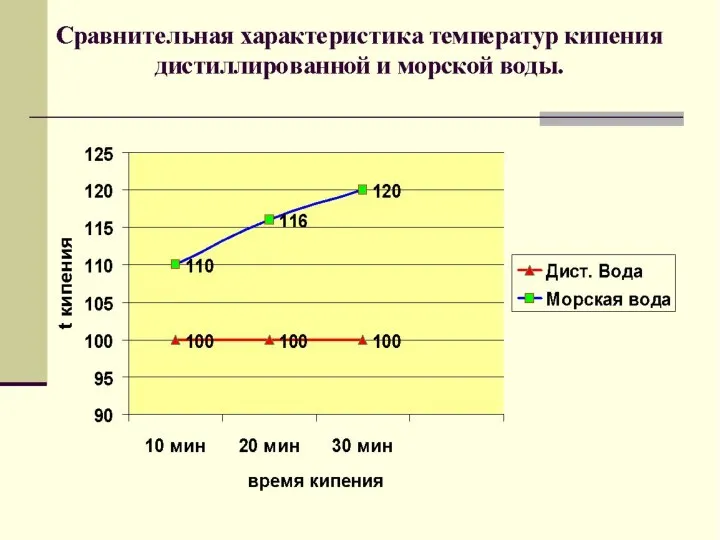
- 7. Чистые вещества обладают постоянными составом. Например: дистиллированная вода Вещества, не содержащие примесей других веществ
- 8. Чистые вещества обладают постоянными физическими свойствами. (tкип, tплав, ρ и др.)
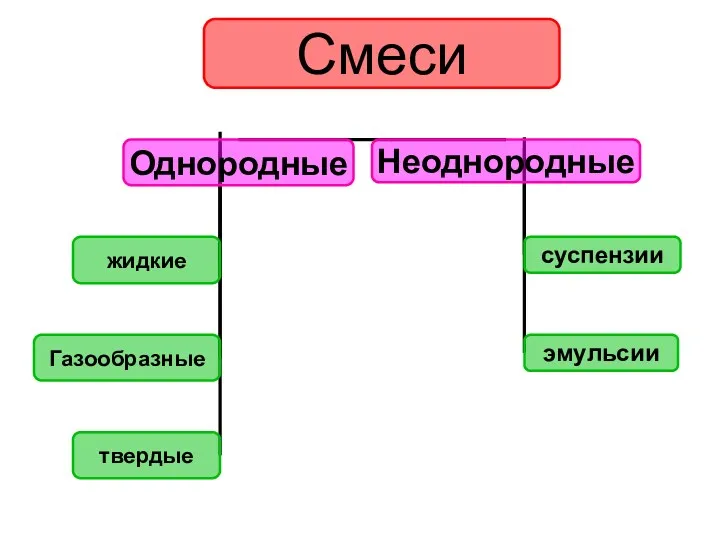
- 9. Смеси состоят из двух или более веществ, которые называют компонентами смеси. Смеси – это комбинация из
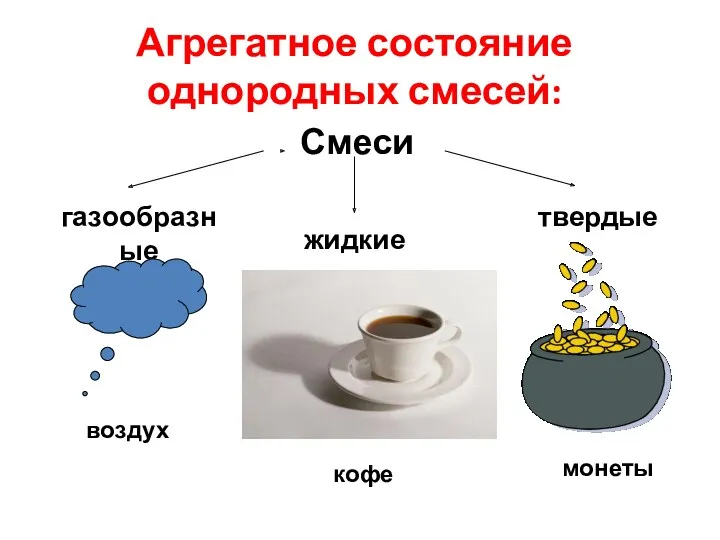
- 11. Агрегатное состояние однородных смесей: Смеси газообразные жидкие твердые воздух кофе монеты
- 12. Однородные смеси В однородных смесях частички веществ различить невозможно.
- 13. Неоднородные смеси В неоднородных смесях невооруженным глазом или с помощью микроскопа моно различить частички вещества (поверхность
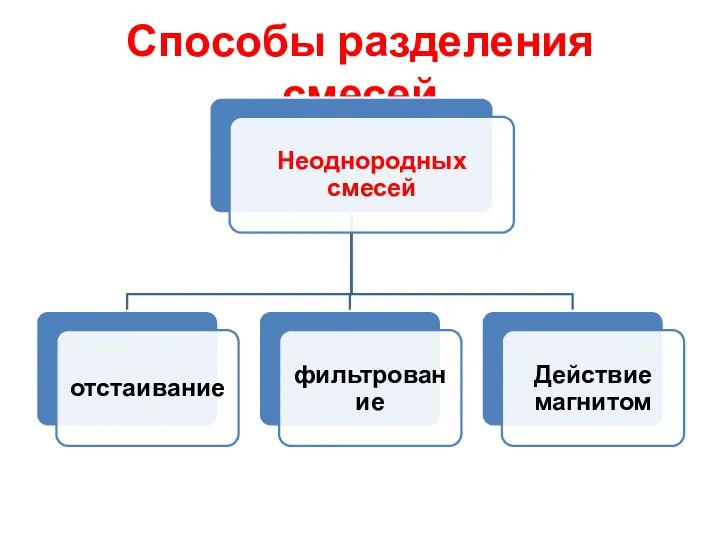
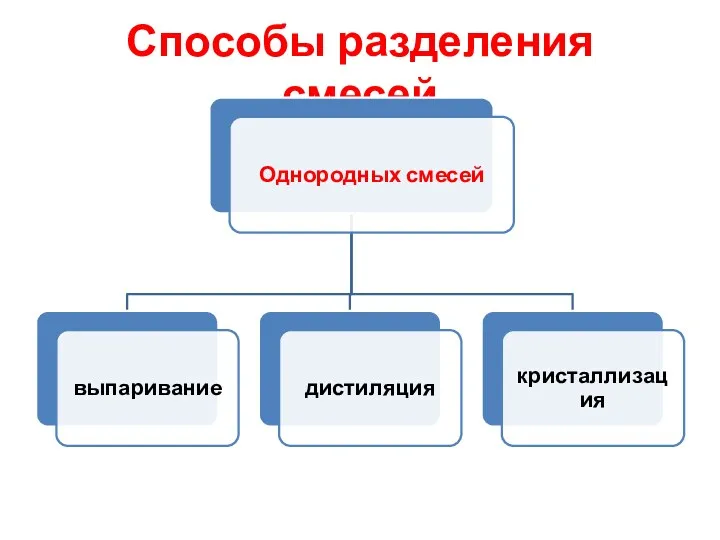
- 14. Способы разделения смесей
- 15. Способы разделения смесей
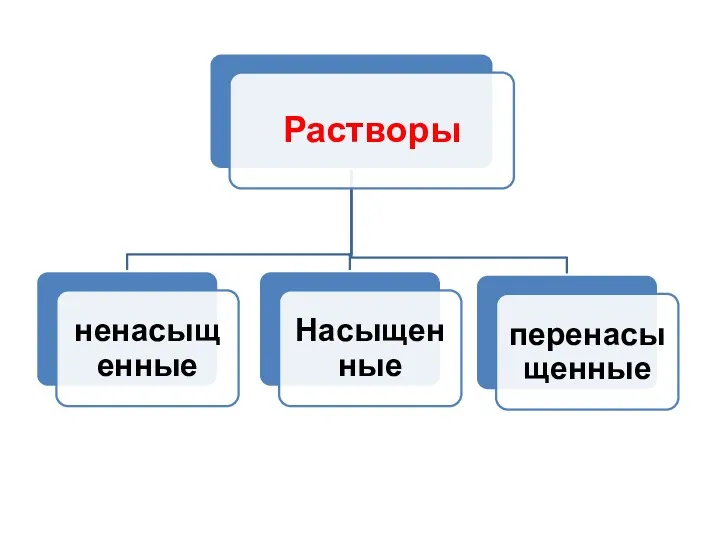
- 16. Растворы Гомогенная или однородная смесь, состоящая из растворенного вещества и растворителя. Раствор = раствроитель + растворенное
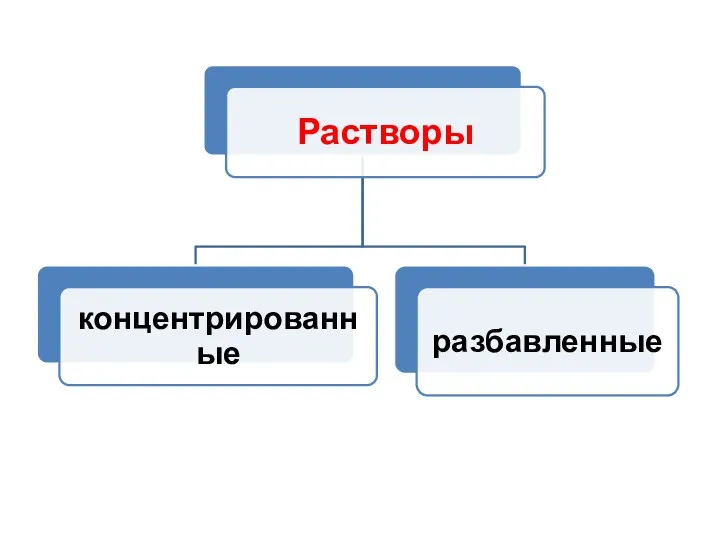
- 19. Способы выражения концентрации растворов Концентрация — величина, характеризующая количественный состав раствора.
- 20. Массовая доля растворённого вещества-это отношение массы растворённого вещества к массе раствора. Для расчёта процентной концентрации используется
- 21. Молярность (молярная концентрация) Молярность — число молей растворённого вещества в единице объёма раствора. где ν -
- 22. Моляльность (моляльная концентрация) Моляльность — число молей растворённого вещества в 1кг растворителя. Измеряется в моль/кг, Так,
- 23. Объёмная доля Объемная доля — отношение объёма растворённого вещества к объёму раствора. Объёмная доля измеряется в
- 24. Задачи Приготовьте раствор нитрата натрия массой 160г массовой долей соли 8 %. В воде растворили гидроксид
- 25. Домашнее задание § 8 чит. В.2,6,7 (п) В.4,5(у)
- 26. 6. К воде массой 200 г прилили 2М раствор хлорида калия объемом 40 мл и плотностью
- 28. Скачать презентацию


















 Удивительные свойства воды
Удивительные свойства воды Electronică aplicată. (Curs 2)
Electronică aplicată. (Curs 2) Пространственное строение органических соединений. (Лекция 2)
Пространственное строение органических соединений. (Лекция 2) 20230416_urok_na_20.02.2023
20230416_urok_na_20.02.2023 Неізогіпсичні перетворення функціональних груп. Реакції окиснення
Неізогіпсичні перетворення функціональних груп. Реакції окиснення Виды присадок к моторным топливам. Присадки к дизельному топливу
Виды присадок к моторным топливам. Присадки к дизельному топливу Электронная конфигурация К. Классификация химических элементов. 8 класс
Электронная конфигурация К. Классификация химических элементов. 8 класс Спирты. Физические и химические свойства
Спирты. Физические и химические свойства Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування
Сучасні методи органічного синтезу. Ізогіпсичні перетворення функціональних груп. Реакції приєднання. Гідроборування 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Классификация органических соединений, углеводородов
Классификация органических соединений, углеводородов Типовые процессы технологии неорганических веществ. (Тема 3)
Типовые процессы технологии неорганических веществ. (Тема 3) ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Изучение строения и свойств глюкозы
Изучение строения и свойств глюкозы Железо и его соединения
Железо и его соединения Химические превращения веществ
Химические превращения веществ Белки. Функции белков
Белки. Функции белков Високомолекулярні сполуки. Полімери
Високомолекулярні сполуки. Полімери Простые спектры 1Н ЯМР
Простые спектры 1Н ЯМР Значення хімічних процесів у природі
Значення хімічних процесів у природі Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас
Реакції йонного обміну між електролітами у водних розчинах. Практична робота №1. 9 клас Реакции ионного обмена
Реакции ионного обмена Жиры. Мыла. 10 класс
Жиры. Мыла. 10 класс Группа редкоземельных элементов
Группа редкоземельных элементов Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі
Аммиак. № 12 зертханалық тәжірибе Аммиак молекуласының моделі Железо
Железо Crystallography. Part 4: Crystal Forms Twinning
Crystallography. Part 4: Crystal Forms Twinning Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)
Функциональные производные с простой связью C-“Э. Галогенпроизводные. (Лекция 5)