Содержание
- 2. Класифікація функціональних груп
- 3. Окиснення спиртів Реагент Джонса (CrO3–H2SO4–ацетон, до кислоти) Реагент Колінза (CrO3–py) PCC (pyH+CrO3Cl–) PDC ((pyH)2Cr2O7) Реагент Сверна
- 4. Окиснення карбонільних сполук Реагент Джонса (CrO3–H2SO4–ацетон) Ag2O–NaOH Реагент Пінніка (NaClO2–(Na2HPO4)–2,3-диметилбутен) MnO2–NaCN Окиснення альдегідів Окиснення кетонів З
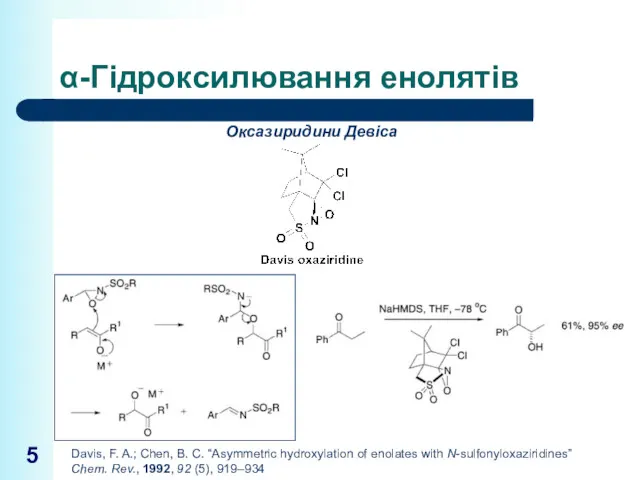
- 5. α-Гідроксилювання енолятів Davis, F. A.; Chen, B. C. “Asymmetric hydroxylation of enolates with N-sulfonyloxaziridines” Chem. Rev.,
- 6. Епоксидування алкенів MCPBA TBHP у присутності перехідних металів (Ti(Oi-Pr)4, VO(acac)2, Mo(CO)6) H2O2 або TBHP у присутності
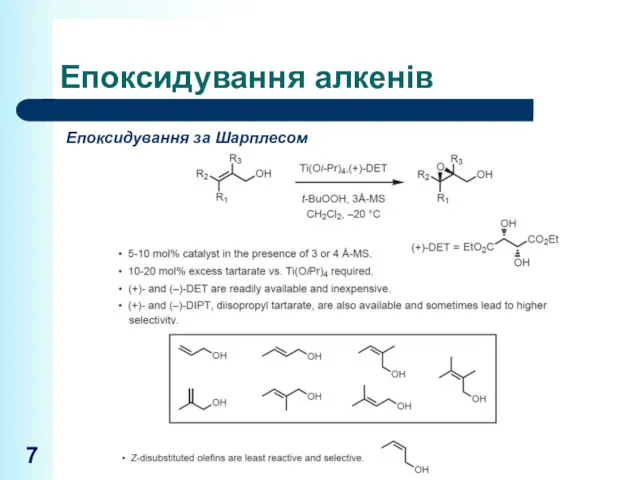
- 7. Епоксидування алкенів Епоксидування за Шарплесом
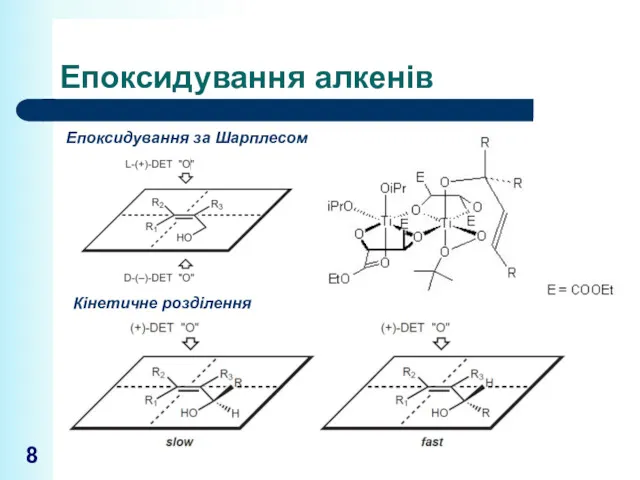
- 8. Епоксидування алкенів Епоксидування за Шарплесом Кінетичне розділення
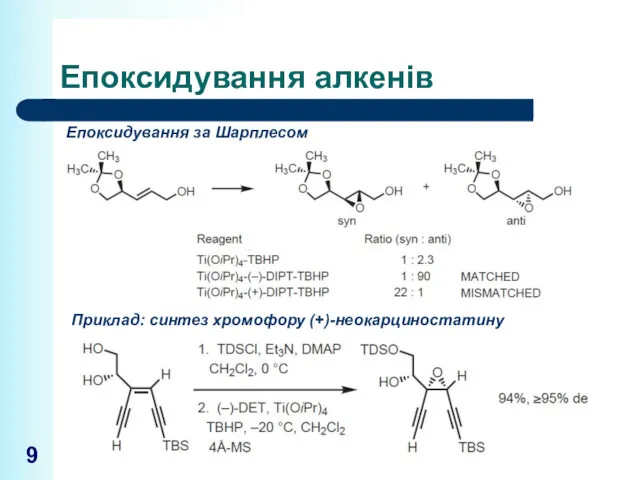
- 9. Епоксидування алкенів Епоксидування за Шарплесом Приклад: синтез хромофору (+)-неокарциностатину
- 10. Епоксидування алкенів Епоксидування за Якобсеном Теrminal olefins are poor substrates. A lot of trisubstituted alkenes are
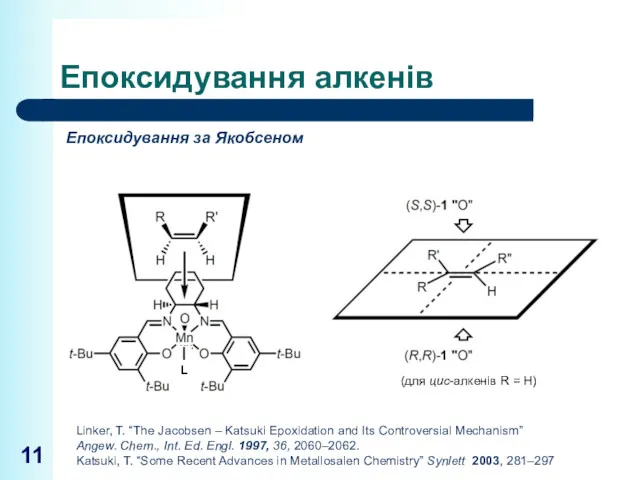
- 11. Епоксидування алкенів Епоксидування за Якобсеном (для цис-алкенів R = H) Linker, T. “The Jacobsen – Katsuki
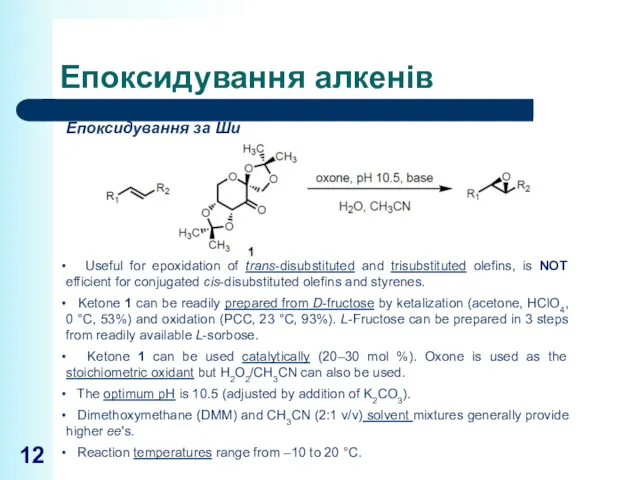
- 12. Епоксидування алкенів Епоксидування за Ши Useful for epoxidation of trans-disubstituted and trisubstituted olefins, is NOT efficient
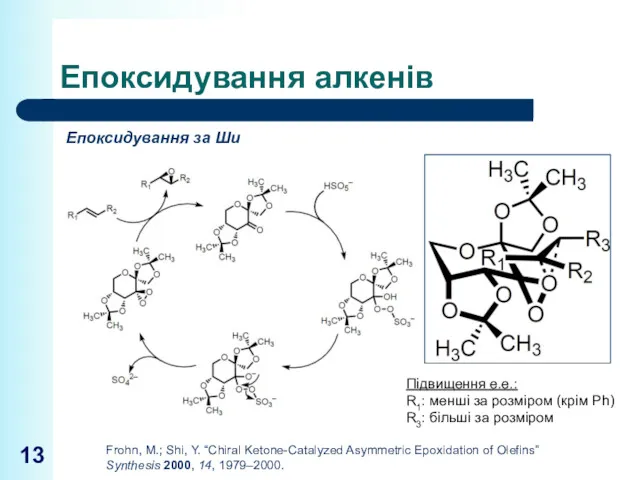
- 13. Епоксидування алкенів Епоксидування за Ши Підвищення е.е.: R1: менші за розміром (крім Ph) R3: більші за
- 14. Цис-гідроксилювання алкенів OsO4 – окисник, що використовується найчастіше Використовується без співокисника або разом з хлоратами (KClO3,Ba(ClO3)2)
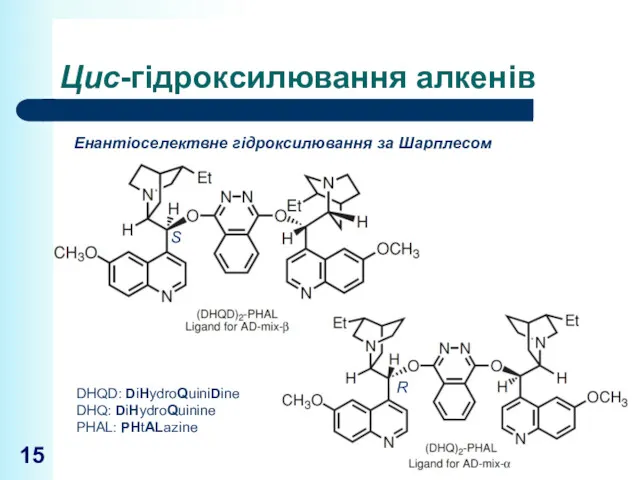
- 15. Цис-гідроксилювання алкенів Енантіоселектвне гідроксилювання за Шарплесом DHQD: DiHydroQuiniDine DHQ: DiHydroQuinine PHAL: PHtALazine S R
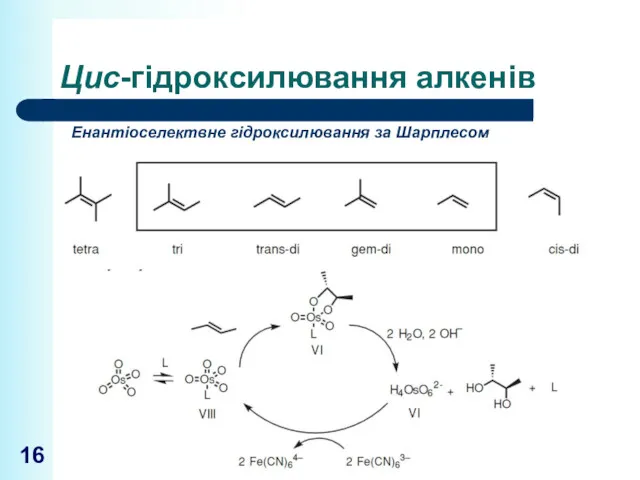
- 16. Цис-гідроксилювання алкенів Енантіоселектвне гідроксилювання за Шарплесом
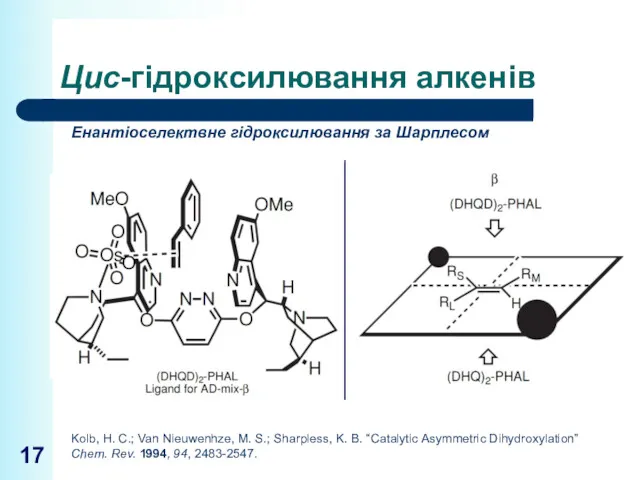
- 17. Цис-гідроксилювання алкенів Енантіоселектвне гідроксилювання за Шарплесом Kolb, H. C.; Van Nieuwenhze, M. S.; Sharpless, K. B.
- 18. Інші реакції окиснення Озон (O3, Me2S) Реагент Лем’є – Джонсона (OsO4 – NaIO4) Pb(OAc)4 RuCl3–NaIO4 Окиснення
- 20. Скачать презентацию







 Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник
Окисно-відновні реакції. Процеси окиснення, відновлення, окисник та відновник Цеолиты. Свойства и область применения
Цеолиты. Свойства и область применения Йод. Йодтың ашылуы
Йод. Йодтың ашылуы Платина. Свойства
Платина. Свойства Нанотехнологии в школьном образовании. Семинар учителей химии
Нанотехнологии в школьном образовании. Семинар учителей химии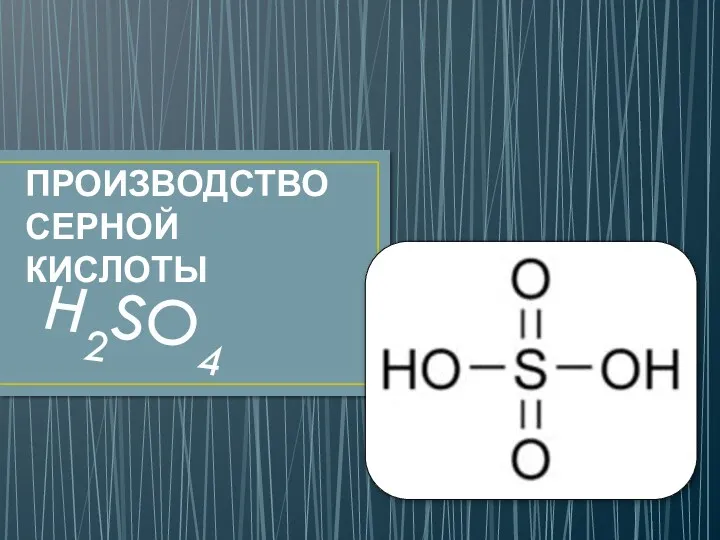 Производство серной кислоты
Производство серной кислоты Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе
Химия элементов. Комплексные соединения. Основные понятия координационной теории. Номенклатура. Поведение в растворе Относительная молекулярная масса вещества. Задачи
Относительная молекулярная масса вещества. Задачи Классификация строительных материалов. Коррозия бетона и железобетона
Классификация строительных материалов. Коррозия бетона и железобетона Органикалық қосылыстардың
Органикалық қосылыстардың Строение атома
Строение атома Ionic polymerization
Ionic polymerization Классификация автомобильных масел
Классификация автомобильных масел Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе
Общая характеристика элементов VA -группы. Азот, распространение, физические и химические свойства. Круговорот в природе Экспериментальные методы измерения изотерм адсорбции. Лекция 4
Экспериментальные методы измерения изотерм адсорбции. Лекция 4 Галогены. Положение в периодической системе. Химические свойства
Галогены. Положение в периодической системе. Химические свойства Виявлення в розчині гідроксид-іонів та йонів Гідрогену. Якісні реакції на деякі йони. Застосування якісних реакцій
Виявлення в розчині гідроксид-іонів та йонів Гідрогену. Якісні реакції на деякі йони. Застосування якісних реакцій Производство серной кислоты
Производство серной кислоты Предмет химии. Вещества и их физические свойства
Предмет химии. Вещества и их физические свойства Отложения и коррозия
Отложения и коррозия Закон сохранения массы веществ. Урок вместе с умной колонкой
Закон сохранения массы веществ. Урок вместе с умной колонкой Металлы. Классификация металлов
Металлы. Классификация металлов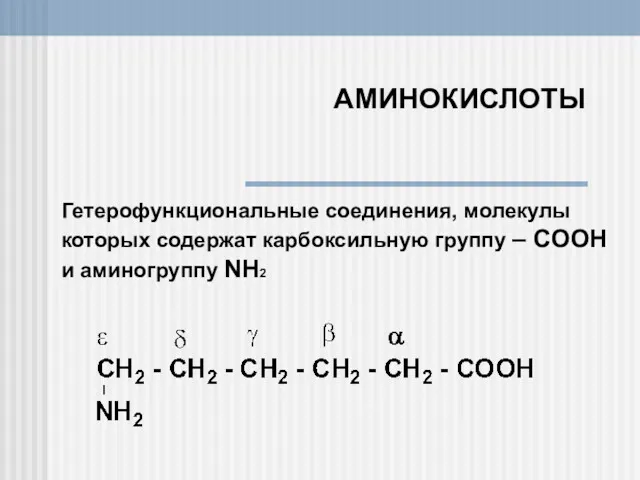 Аминокислоты. Гетерофункциональные соединения, молекулы
Аминокислоты. Гетерофункциональные соединения, молекулы Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии
Анри Ле Шателье. 1850-1963. Принцип Ле Шателье в химии Происхождение химических элементов
Происхождение химических элементов Введение. Развитие химической технологии как науки
Введение. Развитие химической технологии как науки Речовини. Молекули. Атоми
Речовини. Молекули. Атоми Химическая технология ситаллов и композитов
Химическая технология ситаллов и композитов