Содержание
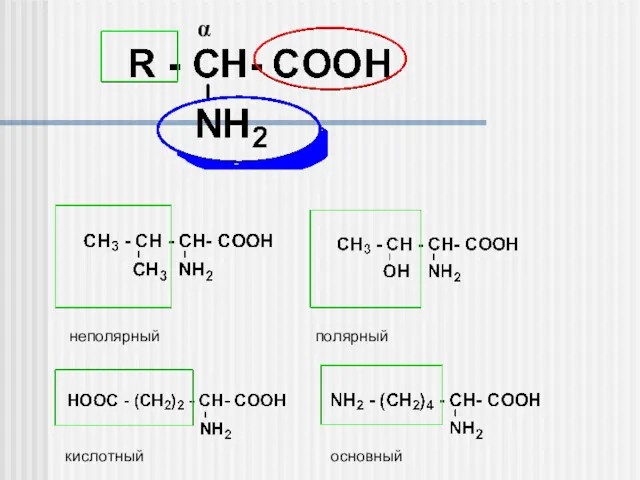
- 2. α неполярный полярный кислотный основный
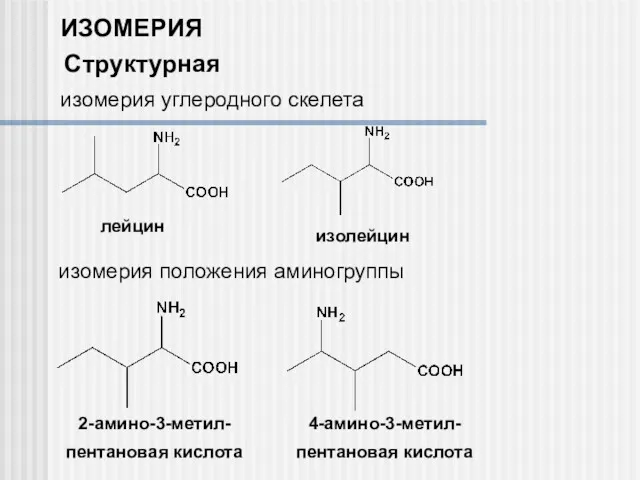
- 3. ИЗОМЕРИЯ Структурная лейцин изолейцин 2-амино-3-метил- пентановая кислота 4-амино-3-метил- пентановая кислота изомерия углеродного скелета изомерия положения аминогруппы
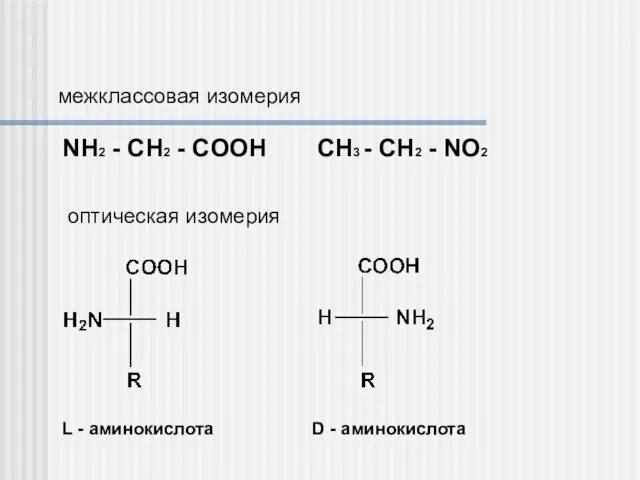
- 4. межклассовая изомерия NH2 - CH2 - COOH СН3 - CH2 - NO2 оптическая изомерия L -
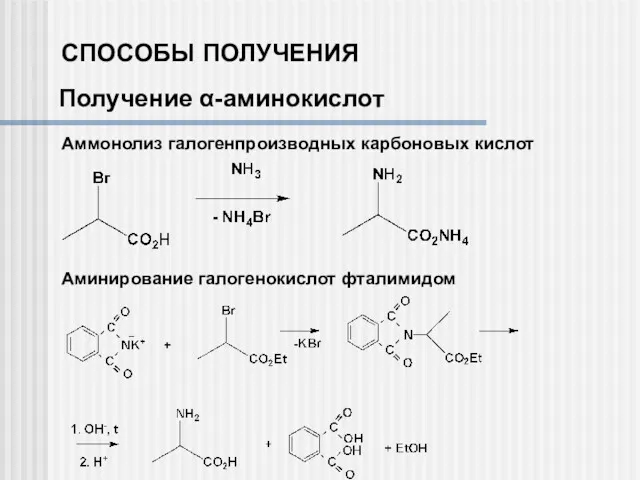
- 5. СПОСОБЫ ПОЛУЧЕНИЯ Получение α-аминокислот Аммонолиз галогенпроизводных карбоновых кислот Аминирование галогенокислот фталимидом
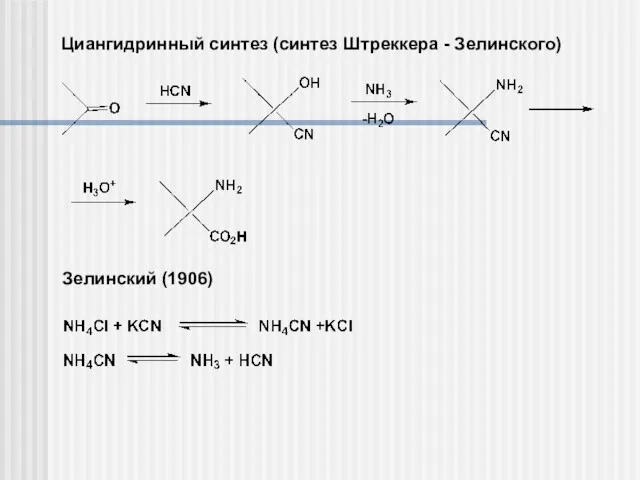
- 6. Циангидринный синтез (синтез Штреккера - Зелинского) Зелинский (1906)
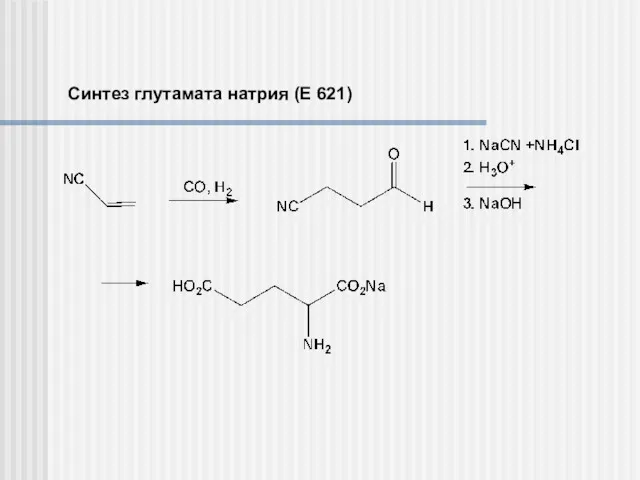
- 7. Синтез глутамата натрия (E 621)
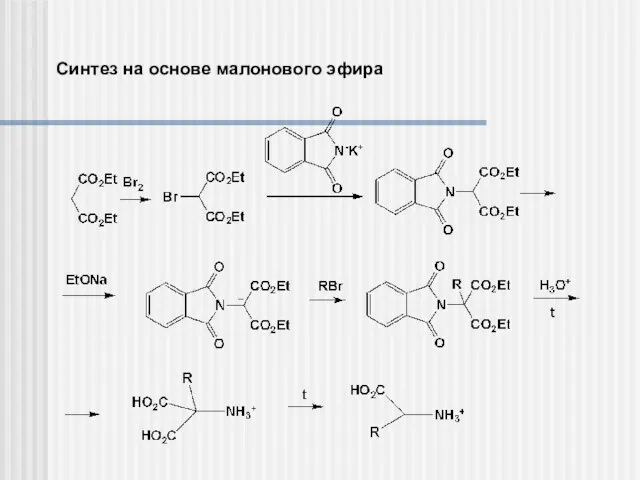
- 8. Синтез на основе малонового эфира
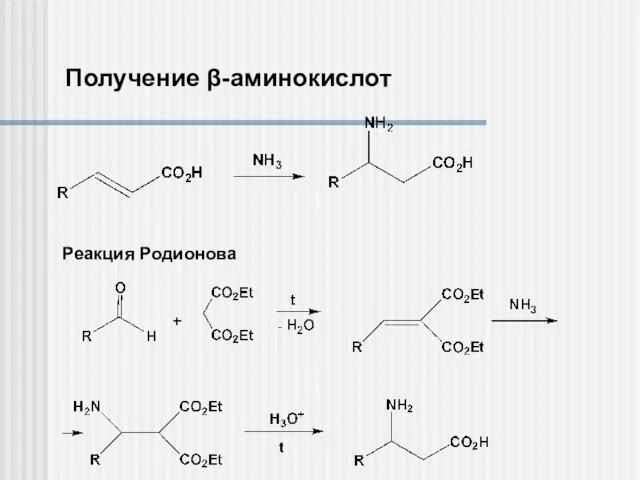
- 9. Получение β-аминокислот Реакция Родионова
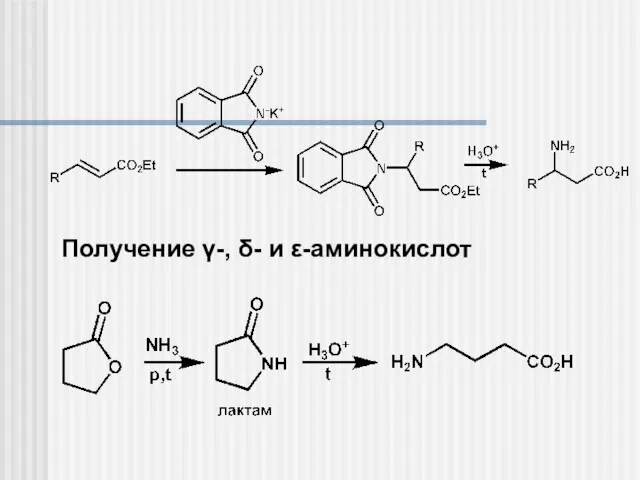
- 10. Получение γ-, δ- и ε-аминокислот
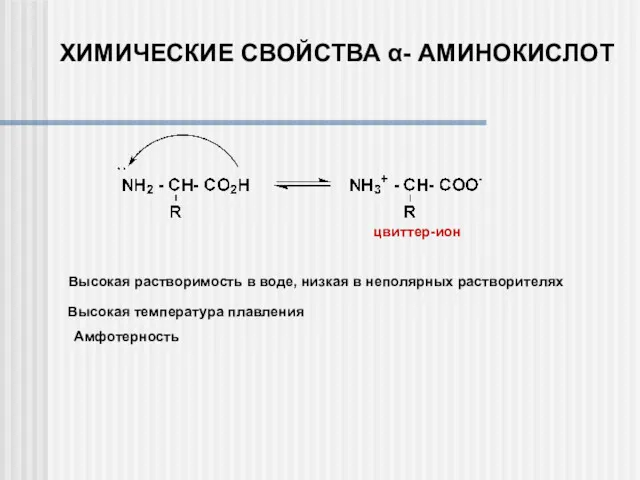
- 11. ХИМИЧЕСКИЕ СВОЙСТВА α- АМИНОКИСЛОТ Высокая растворимость в воде, низкая в неполярных растворителях Высокая температура плавления Амфотерность
- 12. Величина рН, при которой аминокислота не перемещается в электрическом поле, называется изоэлектрической точкой. Каждая аминокислота (и
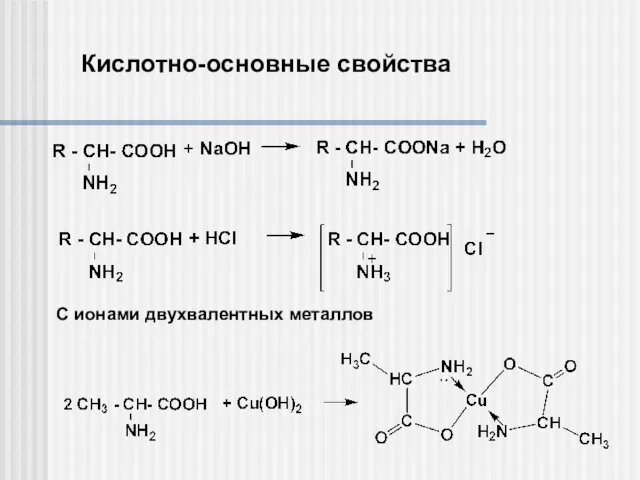
- 13. Кислотно-основные свойства С ионами двухвалентных металлов
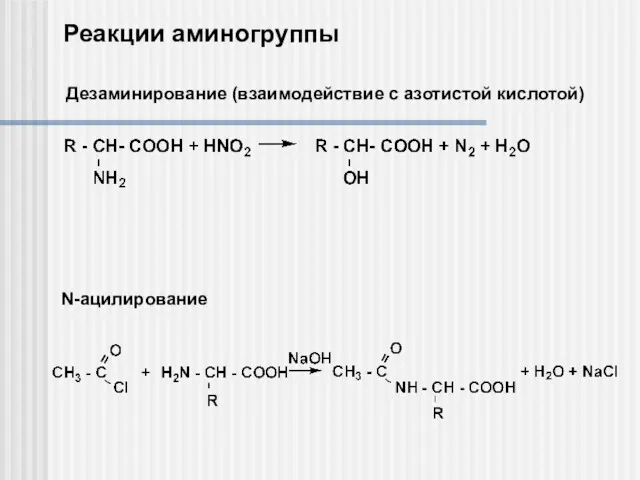
- 14. Реакции аминогруппы Дезаминирование (взаимодействие с азотистой кислотой) N-ацилирование
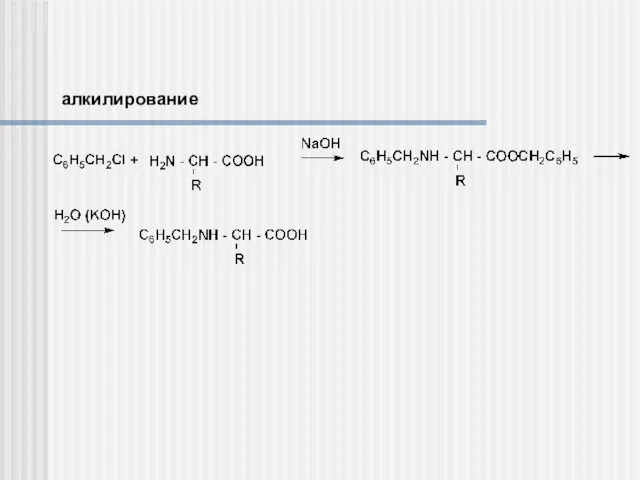
- 15. алкилирование
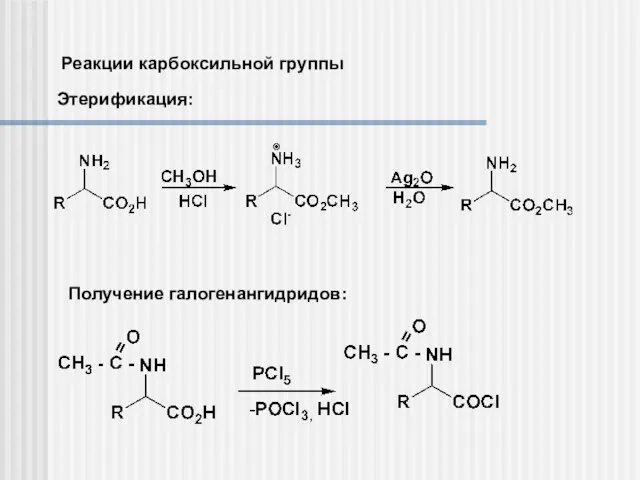
- 16. Реакции карбоксильной группы Этерификация: Получение галогенангидридов:
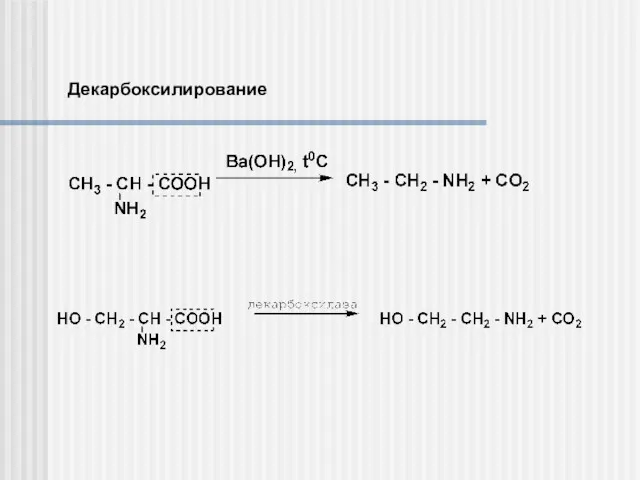
- 17. Декарбоксилирование
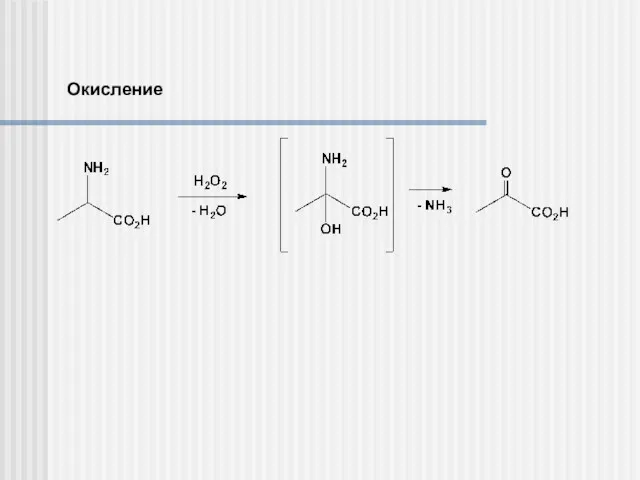
- 18. Окисление
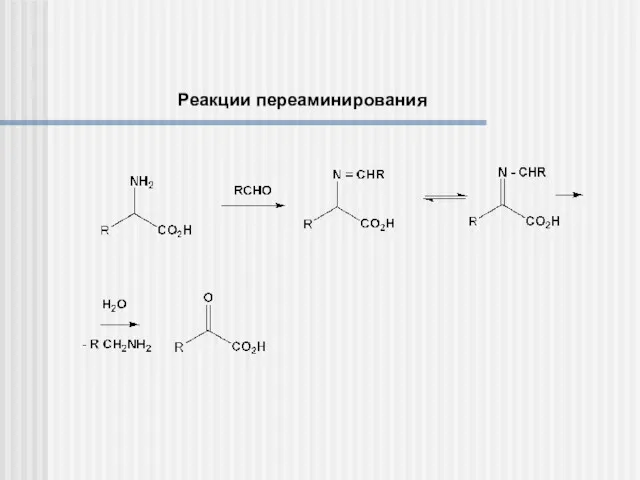
- 19. Реакции переаминирования
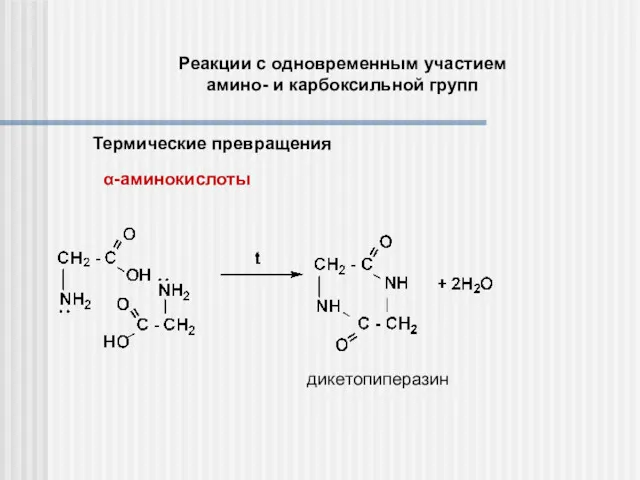
- 20. Реакции с одновременным участием амино- и карбоксильной групп Термические превращения α-аминокислоты дикетопиперазин
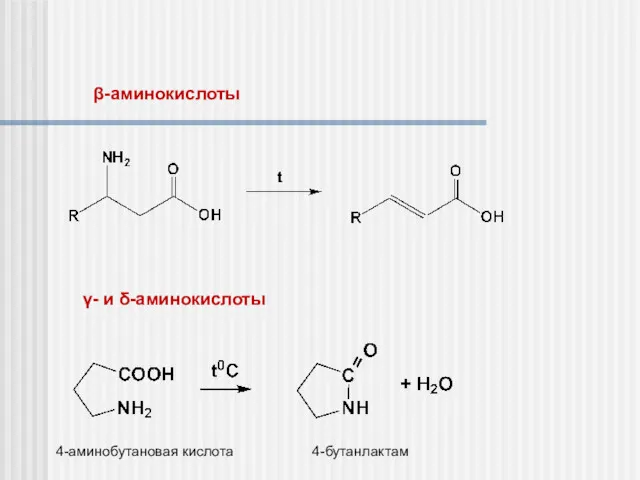
- 21. β-аминокислоты γ- и δ-аминокислоты 4-аминобутановая кислота 4-бутанлактам
- 22. ε-аминокислоты nH2N(CH2)5COOH → -[ NH – (CH2)5 – CO - ]n + nH2O 6-аминогексановая кислота поли-ε-капролактам
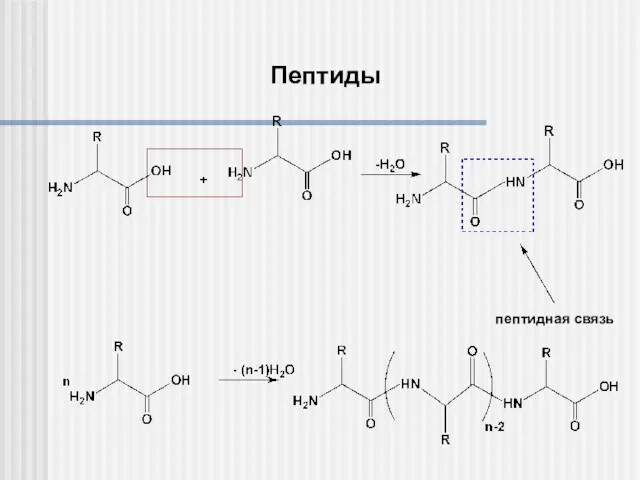
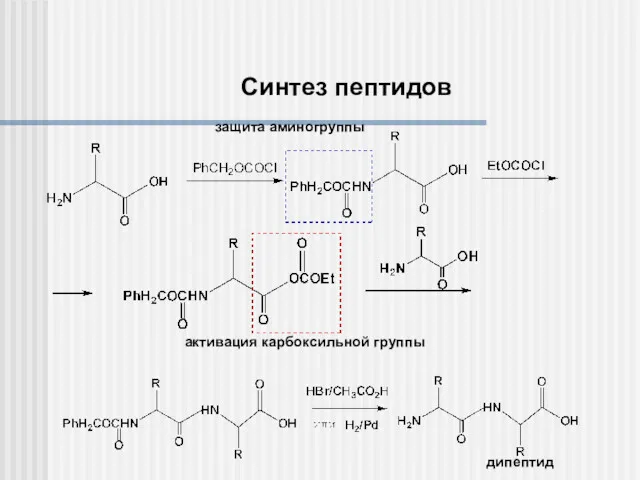
- 23. Пептиды пептидная связь
- 24. дипептид активация карбоксильной группы защита аминогруппы Синтез пептидов
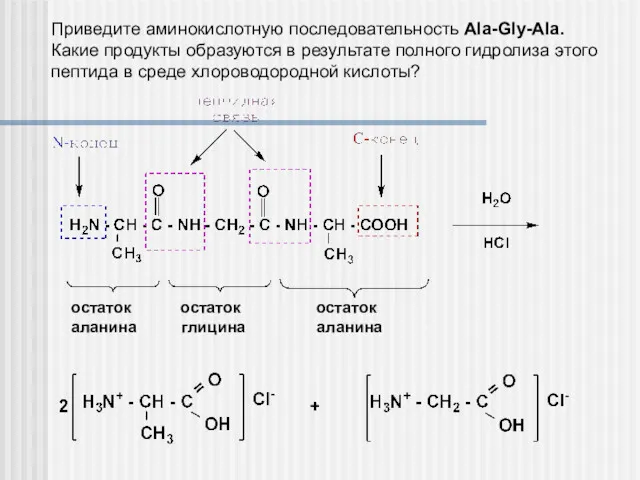
- 25. Приведите аминокислотную последовательность Ala-Gly-Ala. Какие продукты образуются в результате полного гидролиза этого пептида в среде хлороводородной
- 26. Каждый белок имеет свой неповторимый аминокислотный состав и уникальный порядок соединения аминокислот, называемый первичной структурой белка
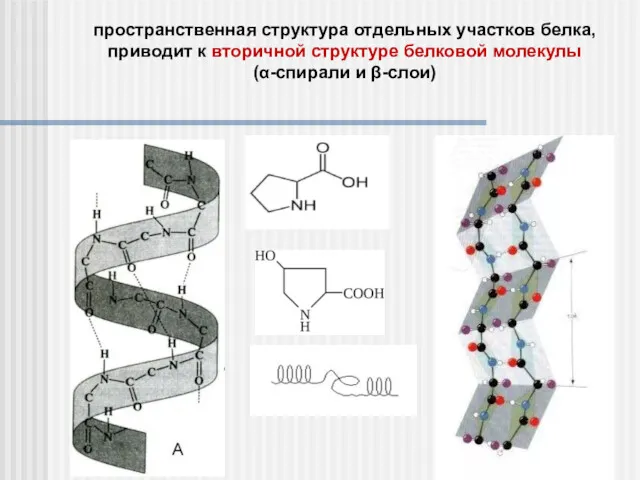
- 27. пространственная структура отдельных участков белка, приводит к вторичной структуре белковой молекулы (α-спирали и β-слои)
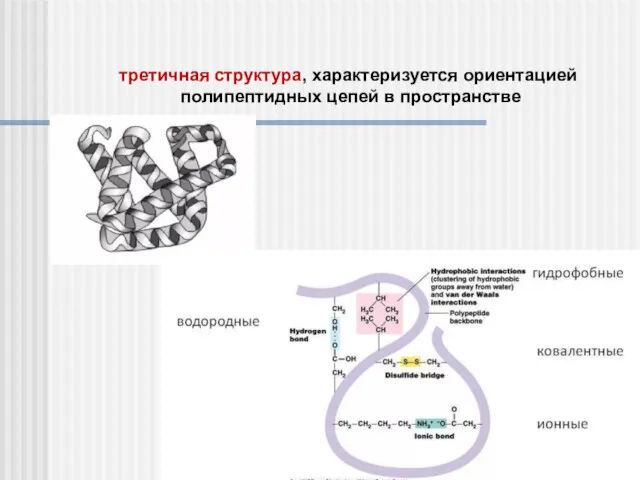
- 28. третичная структура, характеризуется ориентацией полипептидных цепей в пространстве
- 29. четвертичной структурой называют ассоциированные между собой две или более субъединиц, ориентированных в пространстве
- 30. Физико-химические свойства белков 1. Коллоидное состояние белковых веществ 2. Растворимость и осаждаемость белков 3. Денатурация белков
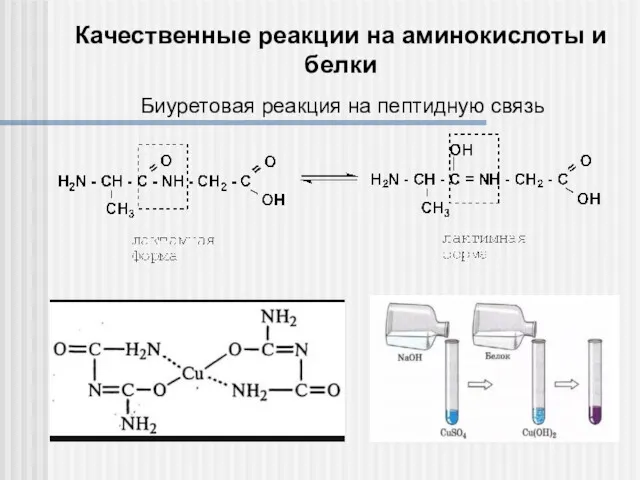
- 31. Качественные реакции на аминокислоты и белки Биуретовая реакция на пептидную связь
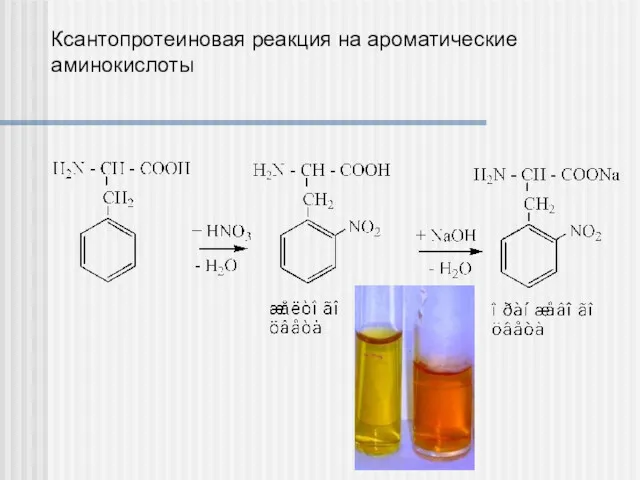
- 32. Ксантопротеиновая реакция на ароматические аминокислоты
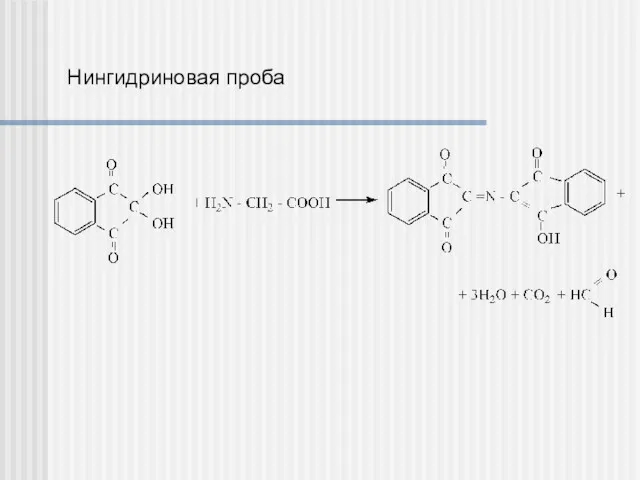
- 33. Нингидриновая проба
- 34. Сульфгидрильная реакция
- 35. Белковые вещества: 1. Простые белки (Протеины) 2. Сложные белки (Протеиды)
- 36. Простые белки – эти макромолекулы состоят только из аминокислотных остатков. Альбумины Глобулины Гистоны Протамины Сложные белки
- 37. Липопротеины - соединения простых белков, с жирами или липоидами Гликопротеины -представляют собой соединения простых белков с
- 38. Биологическая роль пептидов Участвуют в регуляции различных биологических процессов Пептидные гормоны (инсулин, окситоцин, вазопрессин) Пептиды, регулирующие
- 40. Скачать презентацию

![ε-аминокислоты nH2N(CH2)5COOH → -[ NH – (CH2)5 – CO - ]n + nH2O 6-аминогексановая кислота поли-ε-капролактам](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/158823/slide-21.jpg)








 Основные электрохимические процессы
Основные электрохимические процессы Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода
Лекция 5. Нуклеофильное замещение при насыщенном атоме углерода Ядерное топливо
Ядерное топливо Методы определения механических свойств полимерных композиционных материалов
Методы определения механических свойств полимерных композиционных материалов Нанотехнологии. Отдельные представители наночастиц
Нанотехнологии. Отдельные представители наночастиц Основные положения ТЭД
Основные положения ТЭД Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13)
Элементы V группы главной подгруппы. Азот. Фосфор. (Лекция 13) Молекулы и атомы
Молекулы и атомы Генетическая связь неорганических соединений (8 класс)
Генетическая связь неорганических соединений (8 класс) Аллотропия
Аллотропия Агрегатные состояния вещества
Агрегатные состояния вещества Періодична система
Періодична система The role of chemistry in the solution of the food problem
The role of chemistry in the solution of the food problem Аминокислоты. Изомерия. Белки
Аминокислоты. Изомерия. Белки Алкадиены
Алкадиены Средства гигиены
Средства гигиены Степень окисления элементов
Степень окисления элементов АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ.
АМИНОКИСЛОТЫ. ИСТОРИЯ ИХ ОТКРЫТИЯ.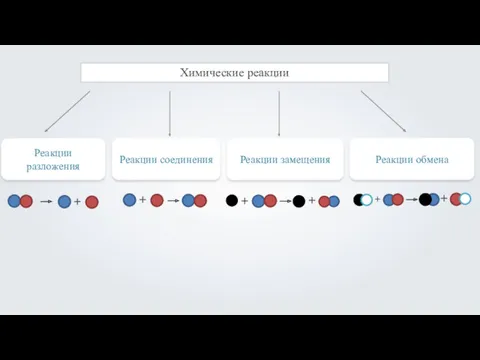 Химические реакции. Реакции разложения
Химические реакции. Реакции разложения Анионактивті беттік активті заттар
Анионактивті беттік активті заттар Серебро
Серебро Медь
Медь Sulfur and its compounds. Contact method for producing sulfuric acid
Sulfur and its compounds. Contact method for producing sulfuric acid Общая характеристика неметаллов
Общая характеристика неметаллов Пневмовакуум-формование
Пневмовакуум-формование Изотопы, их свойства и применение
Изотопы, их свойства и применение Простые вещества - неметаллы
Простые вещества - неметаллы Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл
Зиянды организмдерге қарсы органикалық және органикалық емес қосылыстарды қолдануға негізделген тәсіл