Содержание
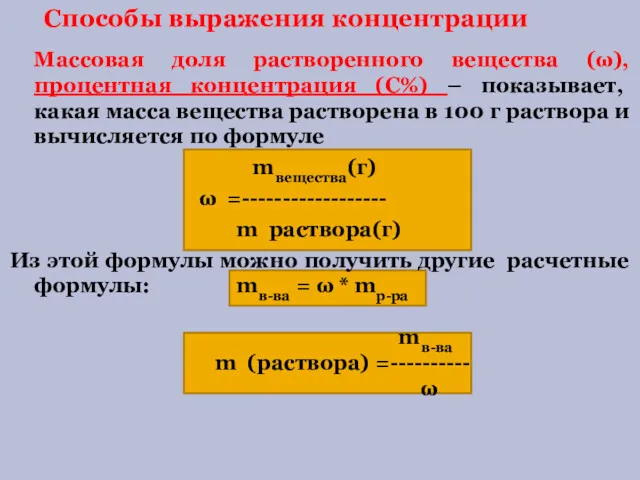
- 2. Массовая доля растворенного вещества (ω), процентная концентрация (С%) – показывает, какая масса вещества растворена в 100
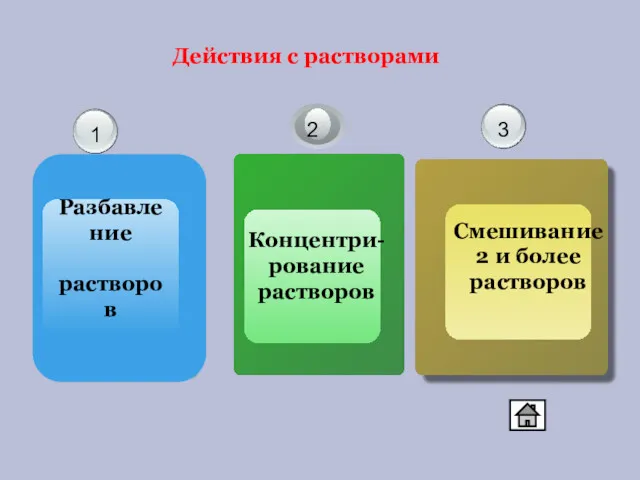
- 3. Действия с растворами Разбавление растворов 1 3 2 Концентри-рование растворов Смешивание 2 и более растворов
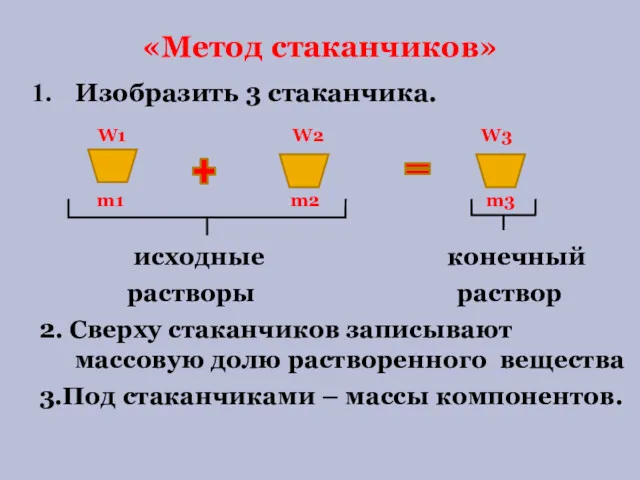
- 4. Изобразить 3 стаканчика. исходные конечный растворы раствор 2. Сверху стаканчиков записывают массовую долю растворенного вещества 3.Под
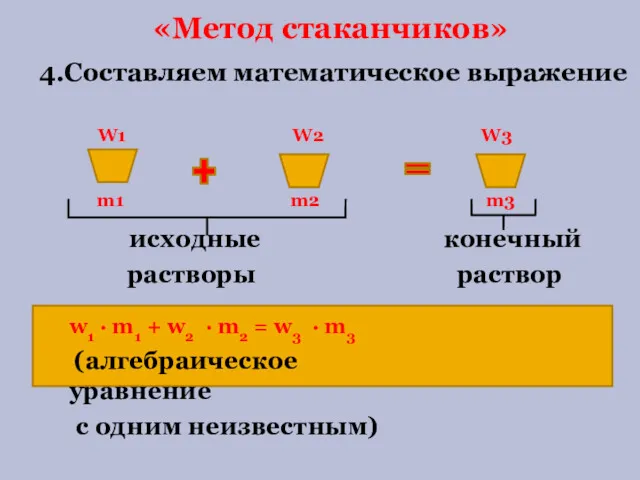
- 5. W1 W2 W3 m1 m2 m3 4.Составляем математическое выражение исходные конечный растворы раствор w1 ∙ m1
- 6. Традиционный способ решения
- 7. Решение задач связанные с разбавлением растворов. Задача. К 120 граммам 5% раствора соли добавили 80 г
- 8. Решение задач связанные со смешиванием растворов. Задача. Смешали 200 граммов раствора с массовой долей соли 0,1
- 9. Решение задач связанные с концентрированием раствора Задача. К 200 граммам 4% раствора соды добавили еще 5
- 10. Решение задач связанные с концентрированием раствора Задача. Из 400 граммов 20% раствора соли упариванием удалили 100
- 11. 1) К раствору хлорида кальция массой 160г и массовой долей 5% добавили 12г этой же соли.
- 12. К 200 г 20%-го раствора гидроксида натрия добавили 80 г воды и 16 г гидроксида натрия.
- 15. Скачать презентацию








 Atomic mass
Atomic mass Бытовая химия
Бытовая химия Каучук. Открытие каучука
Каучук. Открытие каучука Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Окислительновосстановительные реакции (ОВР)
Окислительновосстановительные реакции (ОВР) Кремний и его соединения
Кремний и его соединения Типы химических реакций в органической химии
Типы химических реакций в органической химии Химическая связь. 8 класс
Химическая связь. 8 класс Окислительно-восстановительные реакции. Генетический ряд кальция
Окислительно-восстановительные реакции. Генетический ряд кальция Ациклические углеводороды
Ациклические углеводороды Углеводы (сахариды)
Углеводы (сахариды) Стекло. Виды стекол
Стекло. Виды стекол Физико-химические методы исследования биологически активных веществ
Физико-химические методы исследования биологически активных веществ Коррозия металлов. Методы защиты металлов от коррозии
Коррозия металлов. Методы защиты металлов от коррозии Поверхностные явления на границе раздела фаз. Хроматография, применение в медицинской практике
Поверхностные явления на границе раздела фаз. Хроматография, применение в медицинской практике Цікаві історичні факти з походження назв хімічних елементів
Цікаві історичні факти з походження назв хімічних елементів Химическая промышленность. Минеральные удобрения
Химическая промышленность. Минеральные удобрения Кислород и оксиген
Кислород и оксиген История открытия кислорода
История открытия кислорода Неорганические соединения галогенов
Неорганические соединения галогенов Выращивание кристаллов
Выращивание кристаллов Теплогенерация. Топливо и его горение
Теплогенерация. Топливо и его горение Задачи по химии
Задачи по химии Тіршілік гетерофункционалды қосылыстар
Тіршілік гетерофункционалды қосылыстар Основи. Властивості, застосування гідроксидів Натрію і Калію
Основи. Властивості, застосування гідроксидів Натрію і Калію Бериллий, магний и щелочноземельные металлы
Бериллий, магний и щелочноземельные металлы Коллигативные свойства растворов неэлектролитов
Коллигативные свойства растворов неэлектролитов Методы выделения и очистки продуктов биотехнологических производств
Методы выделения и очистки продуктов биотехнологических производств