Содержание
- 2. Фтор получение в промышленности получают электролизом расплава гидрофторида калия в лабораторных условиях – из фторидов металлов
- 3. Фтор химические свойства при н. у. реагирует со всеми простыми веществами, кроме N2, O2 и легких
- 4. Фториды металлов химические свойства фторид серебра (II) применяется для окислительного фторирования (часто вместе с F2) фторид
- 5. Фториды кислорода получение OF2 получают электролизом плавиковой кислоты или пропусканием фтора через 2% раствор NaOH O2F2
- 6. Фториды кислорода свойства OF2 – мощный фторирующий агент O2F2 неустойчив, разлагается на простые вещества при -78°С
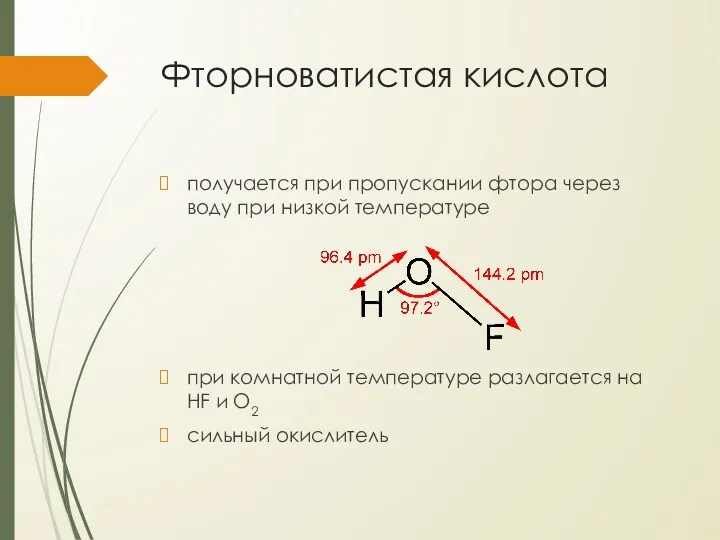
- 7. Фторноватистая кислота получается при пропускании фтора через воду при низкой температуре при комнатной температуре разлагается на
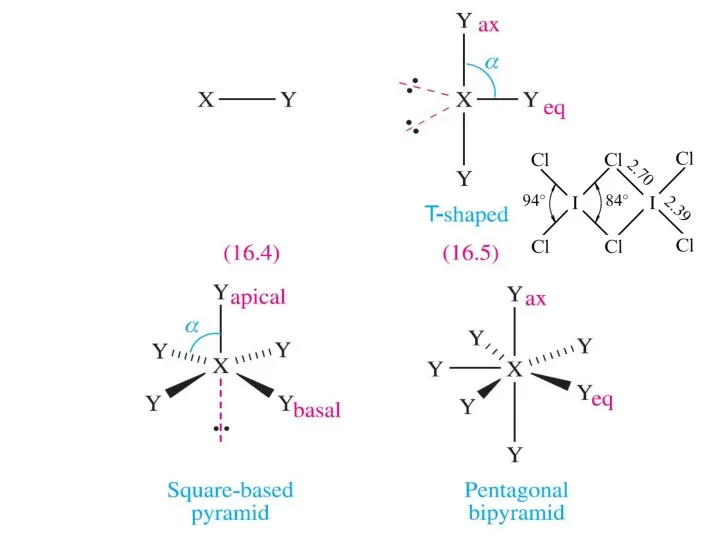
- 8. Межгалогенные соединения (интергалогениды) Галогены образуют соединения друг с другом в четырех стехиометрических соотношениях: XY XY3 XY5
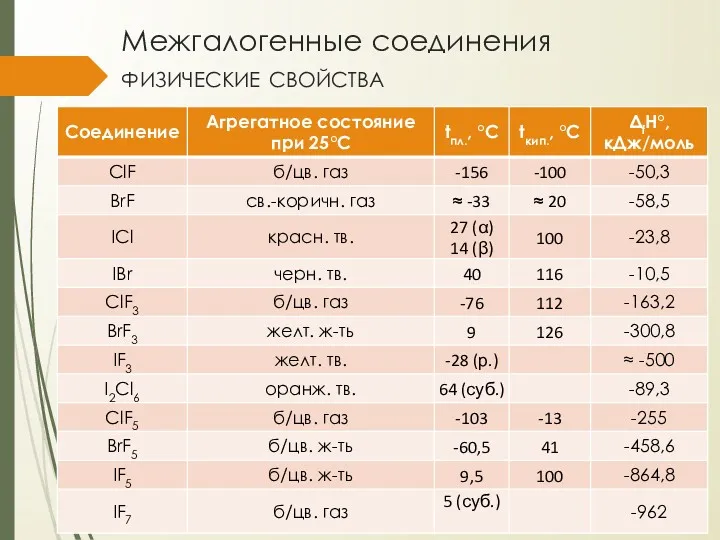
- 10. Межгалогенные соединения физические свойства
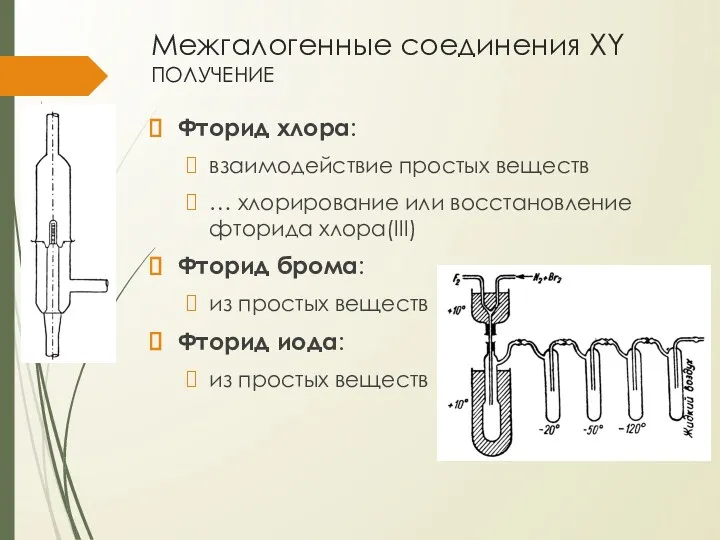
- 11. Межгалогенные соединения XY получение Фторид хлора: взаимодействие простых веществ … хлорирование или восстановление фторида хлора(III) Фторид
- 12. Межгалогенные соединения XY получение Хлорид брома: из простых веществ Хлорид иода: из простых веществ хлорирование иодидов
- 13. Межгалогенные соединения XY3 получение Трифторид хлора: из простых веществ из фторида хлора Трифторид брома: из простых
- 14. Межгалогенные соединения XY5 получение Пентафторид хлора: из простых веществ из трифторида фторирование хлоридов ЩМ Пентафторид брома:
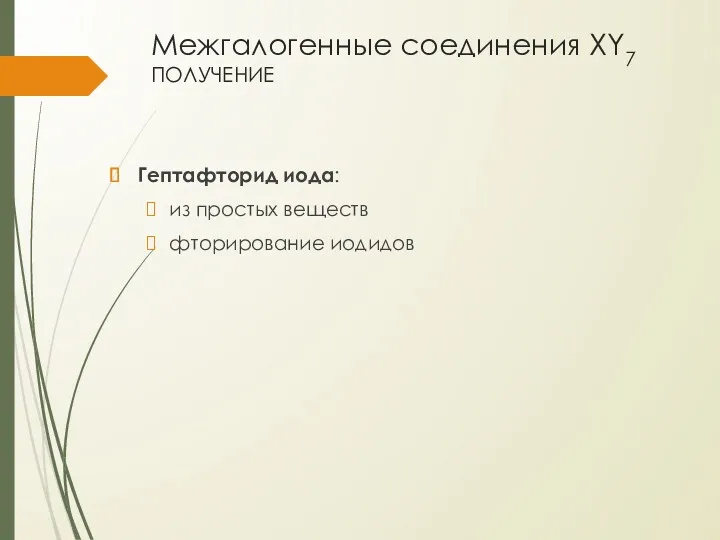
- 15. Межгалогенные соединения XY7 получение Гептафторид иода: из простых веществ фторирование иодидов
- 16. Межгалогенные соединения химические свойства сильные окислители подвергаются гидролизу
- 18. Электролиз межгалогенных соединений
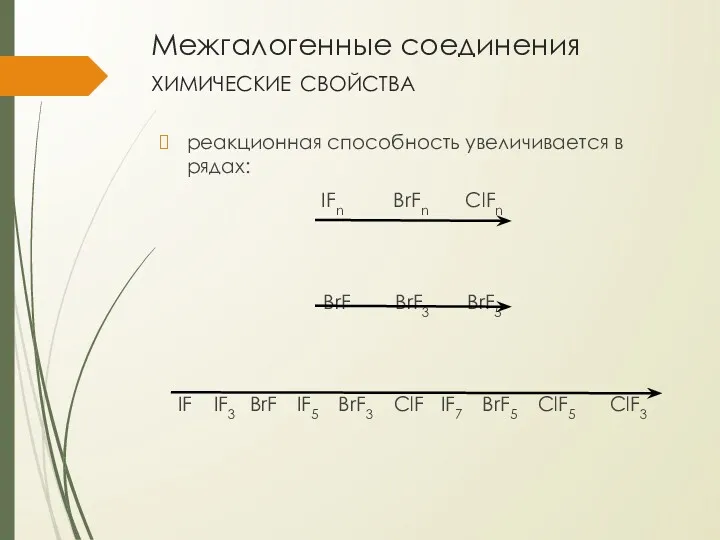
- 19. Межгалогенные соединения химические свойства реакционная способность увеличивается в рядах: IFn BrFn ClFn BrF BrF3 BrF5 IF
- 20. Фториды азота Существует пять фторидов NF3, N2F4, цис- и транс-N2F2, N3F Первый NF3 был получен только
- 21. Фториды азота N2F4 – бесцветный реакционноспособный газ Получается при частичном дефторировании трифторида … окислением NF2H Является
- 22. Фториды азота
- 23. Хлорид, бромид и иодид азота NCl3 - густая летучая желтоватая крайне взрывчатая жидкость, т. пл. =
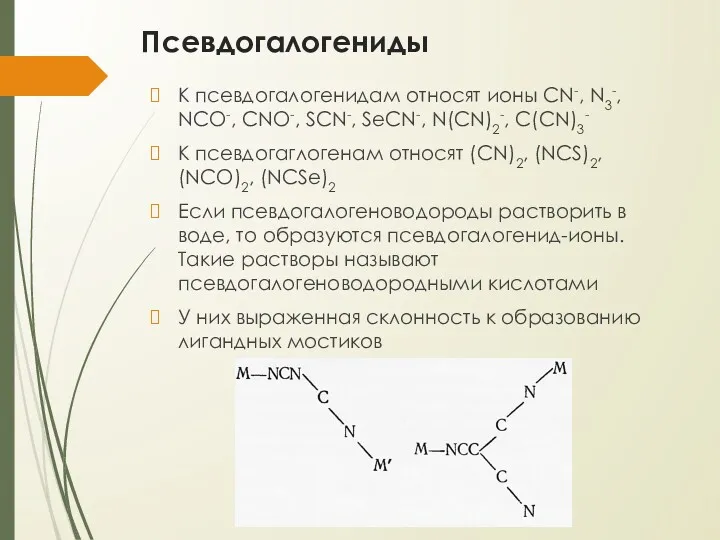
- 24. Псевдогалогениды К псевдогалогенидам относят ионы CN-, N3-, NCO-, CNO-, SCN-, SeCN-, N(CN)2-, C(CN)3- К псевдогаглогенам относят
- 25. Дициан Легковоспламеняющийся бесцветный высокотоксичный газ Образуется при горении угля в электрической дуге в атмосфере азота …
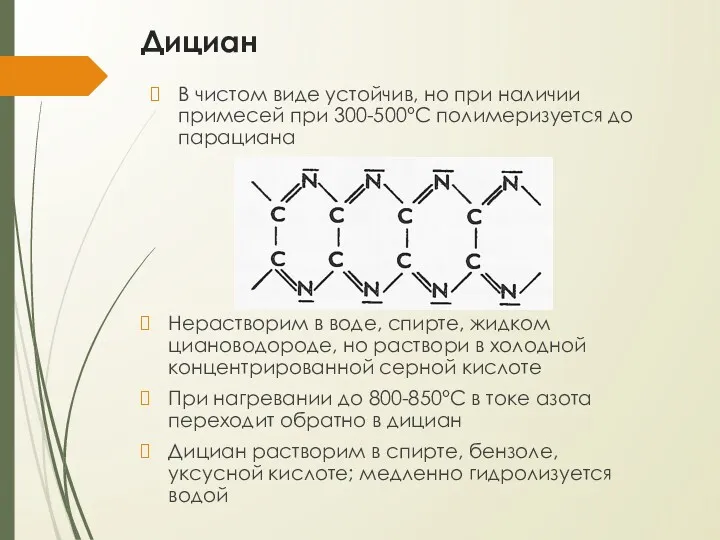
- 26. Дициан В чистом виде устойчив, но при наличии примесей при 300-500°С полимеризуется до парациана Нерастворим в
- 27. Дитиоциан Получается при действии иода или брома на тиоцианат сербра в диэтиловом эфире или тетрахлорметане соответственно
- 29. Скачать презентацию


















 Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Синтетические топлива
Синтетические топлива Определение витамина “С” в продуктах питания с помощью иодометрии
Определение витамина “С” в продуктах питания с помощью иодометрии Геолого-промышленные типы месторождений полезных ископаемых
Геолого-промышленные типы месторождений полезных ископаемых Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Этапы гравиметрического анализа. (Лекция 3)
Этапы гравиметрического анализа. (Лекция 3) Искусственная и синтетическая резина
Искусственная и синтетическая резина Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах
Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах Галогены (солеобразующие)
Галогены (солеобразующие) Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Свойства воды. Оценка качества
Свойства воды. Оценка качества Теплота сгорания топлива
Теплота сгорания топлива Железо и его соединения
Железо и его соединения Коррозия металлов
Коррозия металлов Классы неорганических веществ. Соли
Классы неорганических веществ. Соли Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Анионы. Группы анионов
Анионы. Группы анионов Электронное строение атома
Электронное строение атома Metal–metal multiple bonded intermediates in catalysis
Metal–metal multiple bonded intermediates in catalysis Магний (Mg)
Магний (Mg) Химические свойства солей в свете теории электролитической диссоциации
Химические свойства солей в свете теории электролитической диссоциации Удивительный мир камня
Удивительный мир камня Щелочные металлы
Щелочные металлы Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)
Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)