Содержание
- 2. Сложные вещества Оксиды Гидроксиды Соли Кислоты Основания Амфотерные гидроксиды
- 3. Соли Соли – это сложные вещества, состоящие из ионов металлов и кислотных остатков. Ba SO4 K
- 4. Номенклатура солей + =
- 5. Названия солей бескислородных кислот называем неметалл ( латинское название) с суффиксом – ид (в им. падеже);
- 6. Названия солей кислородсодержащих кислот Называем ион кислотного остатка (в именительном падеже); с суффиксами: -ат для высшей
- 7. Номенклатура солей F – Cl – Br – I – S 2- SO3 2- SO4 2-
- 8. Алгоритм составления формулы соли бескислородной кислоты Первое действие: записываем степени окисления элементов, находим наименьшее общее кратное
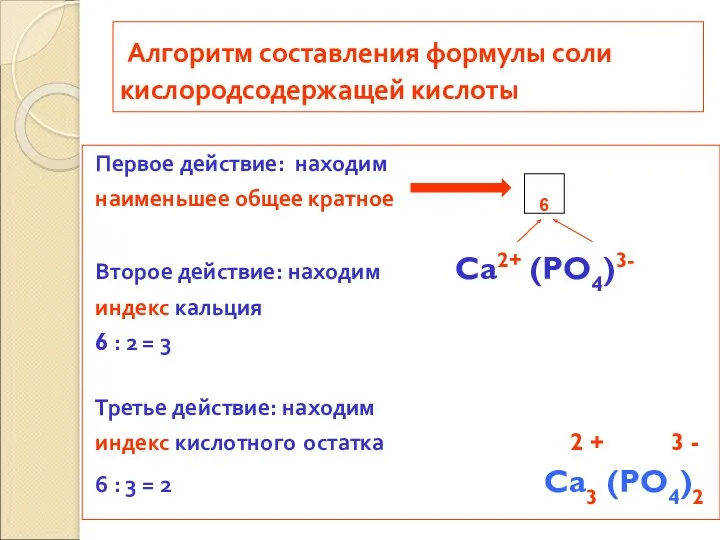
- 9. Алгоритм составления формулы соли кислородсодержащей кислоты Первое действие: находим наименьшее общее кратное Второе действие: находим Ca2+
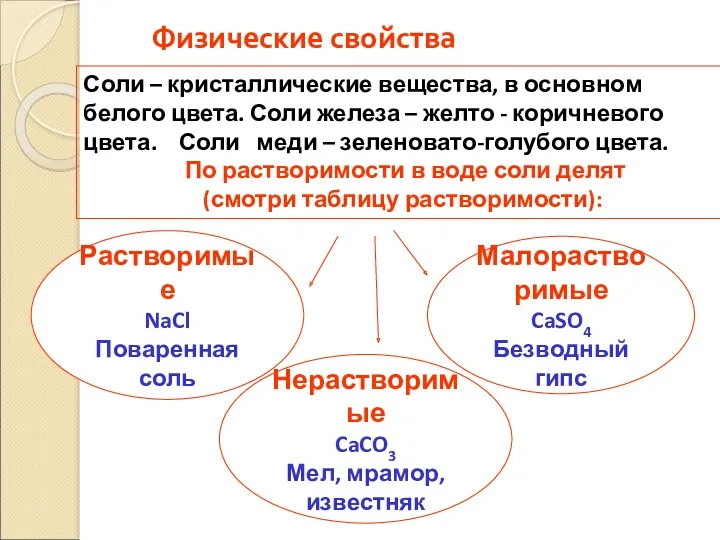
- 10. Физические свойства Растворимые NaCl Поваренная соль Соли – кристаллические вещества, в основном белого цвета. Соли железа
- 11. Типы солей Нормальные (средние) -это соли, в которых все атомы водорода соответствующей кислоты замещены на атомы
- 12. Соли реагируют с металлами( исключения активные металлы: Li, Na, K, Ca, Ba - которые при обычных
- 13. Соли реагируют с некоторыми кислотными оксидами: CaCO3 + SiO2 = CaSiO3 + CO2 Соли реагируют с
- 14. Взаимодействие металлов и неметаллов: 2Fe + 3Cl2 = 2FeCl3 Взаимодействие кислотных оксидов с основными и амфотерными
- 15. Генетическая связь между классами неорганических соединений МЕТАЛЛ ОСНОВНЫЙ ОКСИД ОСНОВАНИЕ СОЛЬ НЕМЕТАЛЛ КИСЛОТНЫЙ ОКСИД КИСЛОТА +
- 17. Скачать презентацию












 Химические свойства металлов
Химические свойства металлов Золото. Что о нём мы можем рассказать?
Золото. Что о нём мы можем рассказать? d-элементы
d-элементы Подготовка к ВПР по химии. 11 класс
Подготовка к ВПР по химии. 11 класс Метаболизм кетоновых тел. Метаболизм холестерина
Метаболизм кетоновых тел. Метаболизм холестерина Химический потенциал. Фазовые равновесия
Химический потенциал. Фазовые равновесия Кислотные дожди
Кислотные дожди The Molecules of Life
The Molecules of Life Цинк и его соединения
Цинк и его соединения Фосфор и его соединения
Фосфор и его соединения Химия воды
Химия воды Закономірності протікання хімічних реакцій
Закономірності протікання хімічних реакцій Классификация химических элементов
Классификация химических элементов Способы выражения состава раствора. Задача 7
Способы выражения состава раствора. Задача 7 НЮ 2.1.1. Металлы - общая характеристика
НЮ 2.1.1. Металлы - общая характеристика Гониометрическое исследование кристаллов
Гониометрическое исследование кристаллов Сплавы железа с углеродом: стали и чугуны
Сплавы железа с углеродом: стали и чугуны Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування
Багатоатомні насичені спирти. Фізичні та хімічні властивості. Добування і застосування Мінерали та гірські породи
Мінерали та гірські породи Серная кислота
Серная кислота Electrolysis
Electrolysis Вещества
Вещества Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Аминокислоты 2
Аминокислоты 2 Метаболизм углеводов
Метаболизм углеводов Спектральные методы: атомная спектроскопия
Спектральные методы: атомная спектроскопия Валентность и степень окисления. Химическая связь
Валентность и степень окисления. Химическая связь Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості
Альдегіди. Карбонові кислоти. Одержання. Фізичні та хімічні властивості