ОСОБОЕ СВОЙСТВО КОНЦЕНТРИРОВАННОЙ
СЕРНОЙ КИСЛОТЫ –
ВЗАИМОДЕЙСТВИЕ С МЕТАЛЛАМИ
При взаимодействии концентрированной серной
кислоты с металлами до водорода возможно образование газа-сероводорода или серы.
Концентрированная серная кислота при нагревании может взаимодействовать с металлами, расположенными в ряду напряжений металлов правее водорода.
При этом продуктом реакции является сернистый газ:
Cu + H2SO4 ----CuSO4 + SO2 + H2O
Zn + H2SO4 ---ZnSO4 + S + H2O
В этих реакциях серная кислота проявляет окислительные свойства, так как сера понижает свою степень окисления.








 Свойства топлив. Марки бензинов и их характеристики
Свойства топлив. Марки бензинов и их характеристики Определение окисляемости воды
Определение окисляемости воды Основные задачи и понятия химической метрологии
Основные задачи и понятия химической метрологии Удивительные свойства воды
Удивительные свойства воды Классификация химических элементов
Классификация химических элементов Классификация и свойства кислот
Классификация и свойства кислот Контроль качества пищевых товаров
Контроль качества пищевых товаров Кислород и оксиген
Кислород и оксиген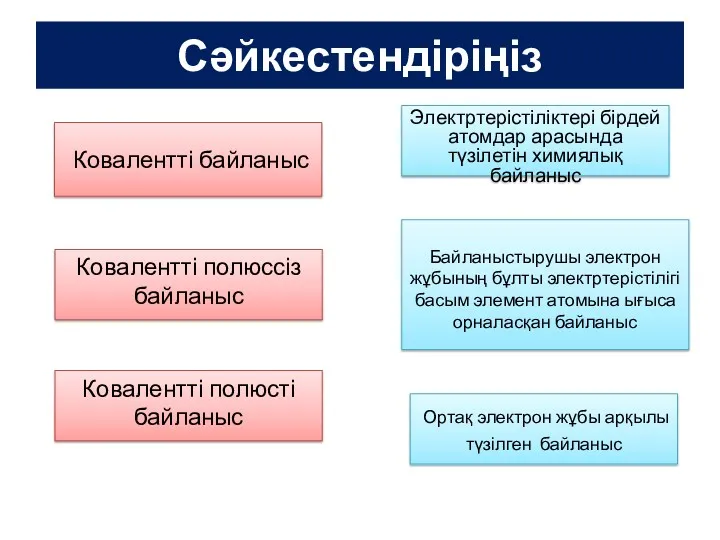 Иондық байланыс
Иондық байланыс Газовые смеси
Газовые смеси Алюминий и его соединения
Алюминий и его соединения Кислород. Химия – 8 класс
Кислород. Химия – 8 класс Углекислый газ СО2
Углекислый газ СО2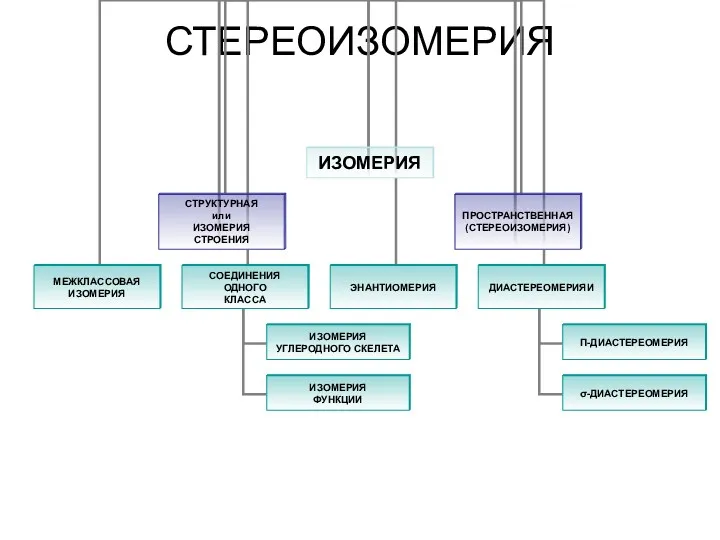 Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета
Стереоизомерия. Изомерия. Пространственная (стереоизомерия) углеродного скелета 20230212_urok_ionnye_uravneniya
20230212_urok_ionnye_uravneniya Ароматические углеводороды (Арены)
Ароматические углеводороды (Арены) Спирти. 3агальна характеристика спиртів
Спирти. 3агальна характеристика спиртів Тотығу-тотықсыздану реакциялары
Тотығу-тотықсыздану реакциялары Растворы. Свойства растворов. (Тема 3)
Растворы. Свойства растворов. (Тема 3) Кондуктометрия и кондуктометрическое титрование
Кондуктометрия и кондуктометрическое титрование Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ)
Гидролиз неорганических веществ (теоретический материал для подготовки к ЕГЭ) Качественный анализ (часть 1)
Качественный анализ (часть 1) Нанопористые материалы
Нанопористые материалы Понятие о спиртах. 9 класс
Понятие о спиртах. 9 класс Щелочные металлы. Положение в ПСХЭ
Щелочные металлы. Положение в ПСХЭ Тайна великого открытия периодической таблицы
Тайна великого открытия периодической таблицы Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла
Разработка проектных решений по переводу паровых котлов электростанций в конденсационный режим с целью увеличения кпд котла Понятие биогенности химических элементов
Понятие биогенности химических элементов