Содержание
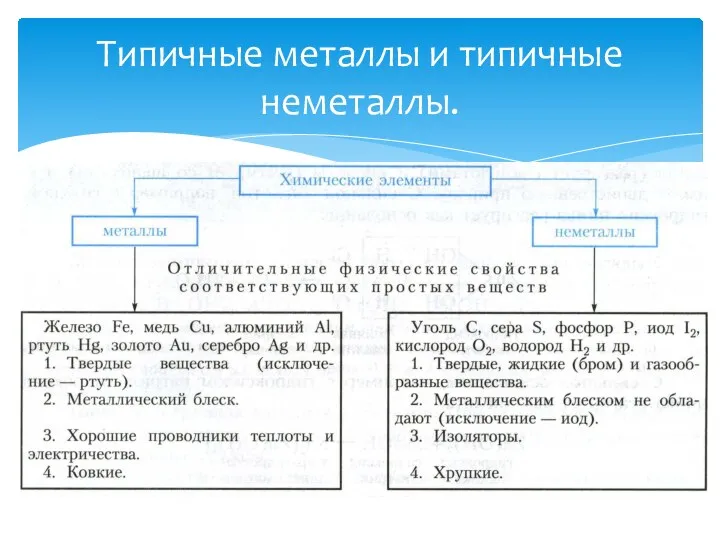
- 3. Типичные металлы и типичные неметаллы.
- 4. Типичный металл взаимодействует с кислородом и образует основный оксид: Na2O, MgO, CaO, BaO, K2O. 2Ca +
- 5. Найди соответствие, для этого выбери каждому номеру букву верного утверждения: 1.Ртуть А. Твердое вещество 2.сера Б.
- 6. 1- Б, В, Ж. 2 – А, Д. 3 – А, Б, Г, Ж. 4 -
- 7. Есть элементы, которые образуют оксиды и гидроксиды, проявляющие амфотерные свойства. Амфотерными называют оксиды и гидроксиды, которые
- 8. Оксид цинка взаимодействует с кислотами образуя соль и воду: ZnO + H2SO4 = ZnSO4, следовательно, оксид
- 9. Оксид и гидроксид цинка взаимодействуют с сильными щелочами и образуют соль и воду: ZnO + 2NaOH
- 10. Составьте уравнения реакций, доказывающих амфотерный характер оксида и гидроксида алюминия Al2O3 + 6HNO3 =2 Al(NO3)3 +
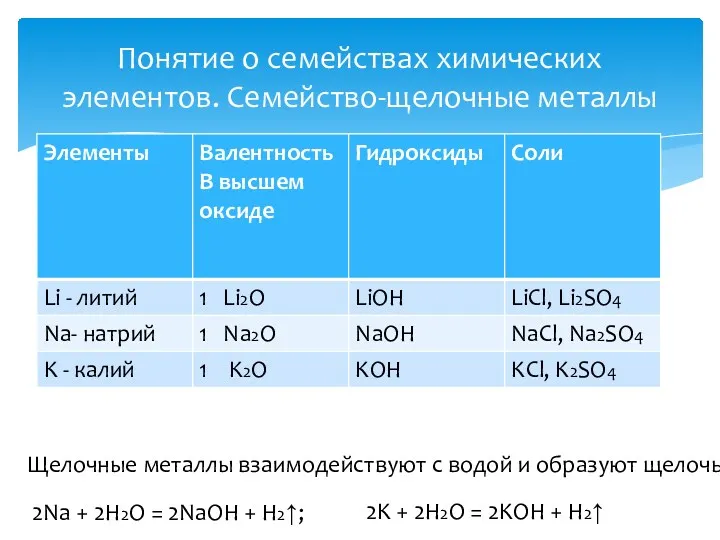
- 11. Понятие о семействах химических элементов. Семейство-щелочные металлы Щелочные металлы взаимодействуют с водой и образуют щелочь 2Na
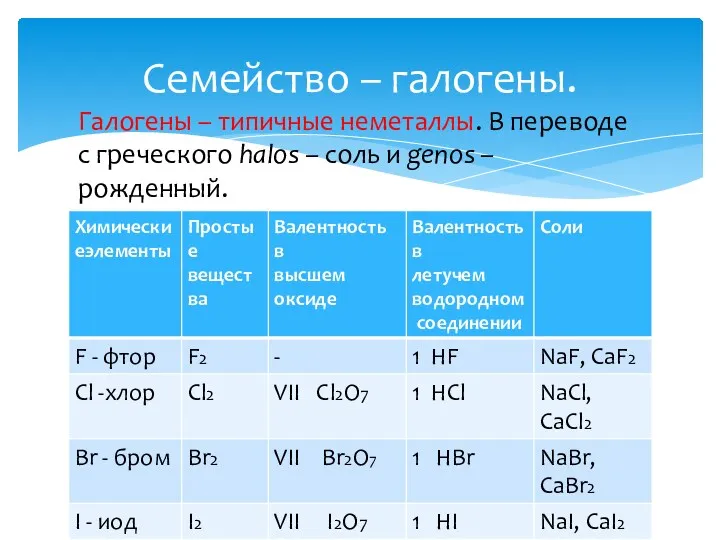
- 12. Семейство – галогены. Галогены – типичные неметаллы. В переводе с греческого halos – соль и genos
- 13. Многие химики: немецкие ученые И. Деберейнер и Л. Мейер, англичанин Дж. Ньюлендс, француз А. Шанкуртуа и
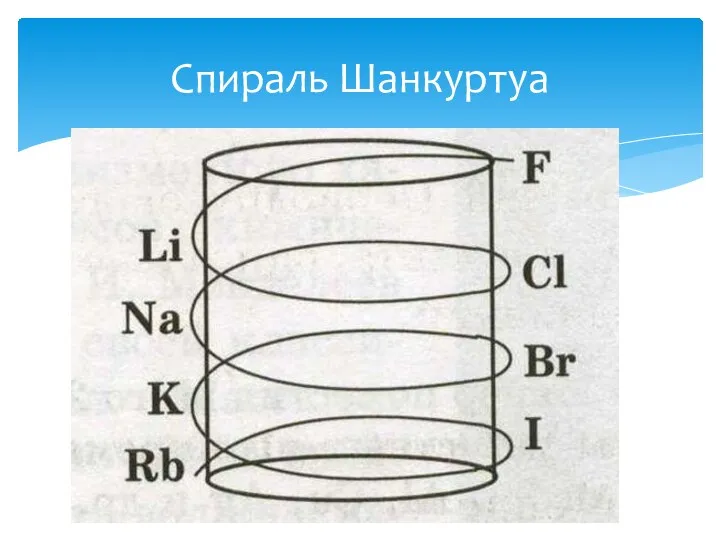
- 14. Спираль Шанкуртуа
- 15. Закон октав Дж. Ньюлендса
- 16. Триады Дёберейнера Триады Деберейнера (1816 г.). Немецкий химик И. В. Деберейнер разделил элементы по три на
- 17. Таблица химических элементов Л. Мейера
- 21. С возрастанием атомного веса 1)металлические свойства постепенно ослабевают (Na Mg Al Si), а неметаллические усиливаются (Si,
- 22. Свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величины
- 23. Почему свойства химических элементов, расположенных в порядке возрастания относительных атомных масс, изменяются периодически? Почему в некоторых
- 25. Скачать презентацию


















 Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс
Основные понятия аналитической химии. Положения теории растворов электролитов и закона действующих масс Природные источники углеводородов
Природные источники углеводородов Теория диаграмм состояния
Теория диаграмм состояния Удобрения и их классификация
Удобрения и их классификация Растворы. Термодинамическая теория растворов
Растворы. Термодинамическая теория растворов Неметаллы – простые вещества
Неметаллы – простые вещества Серебро
Серебро Комплексиметрическое титрование
Комплексиметрическое титрование Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Закон сохранения массы веществ
Закон сохранения массы веществ Титриметрический анализ. (Лекция 22)
Титриметрический анализ. (Лекция 22) Строение атома, изотопы
Строение атома, изотопы Йод. Йодтың ашылуы
Йод. Йодтың ашылуы Етери та естери
Етери та естери Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции
Новые требования к оценке опасности, паспортам безопасности и маркировке химической продукции Окислительно – восстановительные реакции
Окислительно – восстановительные реакции Періодична система хімічних елементів
Періодична система хімічних елементів Ионные уравнения
Ионные уравнения Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури
Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури Изотопная геохимия
Изотопная геохимия Полифункциональные органические соединения
Полифункциональные органические соединения Бинарные соединения
Бинарные соединения Органическая химия. Лекция - Оксокислоты
Органическая химия. Лекция - Оксокислоты Борьба с биологической коррозией
Борьба с биологической коррозией Состав, строение и свойства натурального каучука
Состав, строение и свойства натурального каучука Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9
Карбон қышқылдар, түрлері қасиеттері, түындылары. Лекция № 8. Гетерофункционалды қосылыстар. Лекция № 9 Обед под микроскопом. Минеральные вещества
Обед под микроскопом. Минеральные вещества Классификация минералов в соответствии с систематикой, утвержденной IMA
Классификация минералов в соответствии с систематикой, утвержденной IMA