Обчислення швидкості хімічних реакцій в залежності від концентрації реагуючих речовин і температури презентация
Содержание
- 2. Швидкість хімічної реакції – це зміна концентрації однієї з реагуючих речовин за одиницю часу в однаковому
- 3. Обчислення швидкості реакції за зміною концентрації однієї з реагуючих речовин V = С2 - С1 =
- 4. Дано: Н2 + Cl2 = 2HCl С2(Н2) = 0,04 моль/л С1(Н2) = 0,01 моль/л ∆ t
- 5. Обчислення швидкості реакції за зміною концентрації обох вихідних речовин за законом діючих мас: Швидкість хімічної реакції
- 6. Наприклад. У скільки разів збільшиться швидкість реакції якщо концентрація реагуючих речовин з 1 моль/л збільшити y
- 7. Дано: 2СО + О2 = 2СО2 С1(СО) = 1 моль/л С1(О2) = 1 моль/л С2(СО) =
- 8. Обчислення швидкості реакції за зміною температури Швидкість хімічної реакції при збільшенні температури зростає. Згідно з правилом
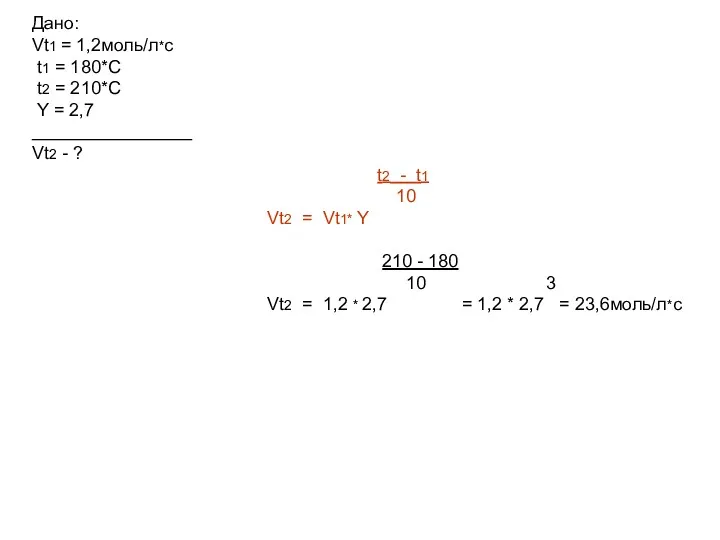
- 9. Наприклад Швидкість реакції при температурі 180*С дорівнює 1,2моль/л*с. Чому дорівнює швидкість цієї реакції при 210*С, якщо
- 10. Дано: Vt1 = 1,2моль/л*с t1 = 180*С t2 = 210*С Y = 2,7 ________________ Vt2 -
- 12. Скачать презентацию








 Химия в повседневной жизни человека
Химия в повседневной жизни человека Химические тест-методы анализа экологических проб. Лекция 6
Химические тест-методы анализа экологических проб. Лекция 6 Значення хімічних процесів у природі
Значення хімічних процесів у природі Диаграмма железо - углерод
Диаграмма железо - углерод 36fd4612109c46a6a8f3b83635fe0e02
36fd4612109c46a6a8f3b83635fe0e02 Основы химического равновесия
Основы химического равновесия Природные источники углеводородов и их переработка
Природные источники углеводородов и их переработка Основные классы неорганических соединений
Основные классы неорганических соединений Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9)
Спирты, фенолы, простые эфиры и их тиоаналоги. (Лекция 9) Що ховається за цифрами? Харчові домішки
Що ховається за цифрами? Харчові домішки Характеристика хімічного елемента Hg
Характеристика хімічного елемента Hg Теоретические основы химической технологии переработки природных энергоносителей и углеводородных материалов
Теоретические основы химической технологии переработки природных энергоносителей и углеводородных материалов Непредельные углеводороды. Алкины
Непредельные углеводороды. Алкины Centrifugal Ultrafiltration Devices
Centrifugal Ultrafiltration Devices Химический элемент и вещество
Химический элемент и вещество Номенклатура органических соединений
Номенклатура органических соединений Хром, марганец
Хром, марганец Классификация химических реакций в неорганической химии
Классификация химических реакций в неорганической химии Managing chemicals. Green chemistry for every laboratory
Managing chemicals. Green chemistry for every laboratory Химиядан сұрақтар
Химиядан сұрақтар Металлы. Металлы главной подгруппы
Металлы. Металлы главной подгруппы Цепные химические реакции
Цепные химические реакции Химическая термодинамика. Лекция 3
Химическая термодинамика. Лекция 3 Витаминные препараты
Витаминные препараты Водород
Водород Электролитическая диссоциация
Электролитическая диссоциация Периодический закон и периодическая система химических элементов
Периодический закон и периодическая система химических элементов Введение в химию. 8 класс
Введение в химию. 8 класс