Содержание
- 2. Какие виды химической связи вам известны? Перечислите типы кристаллических решёток. Перечислите важнейшие классы неорганических веществ. Приведите
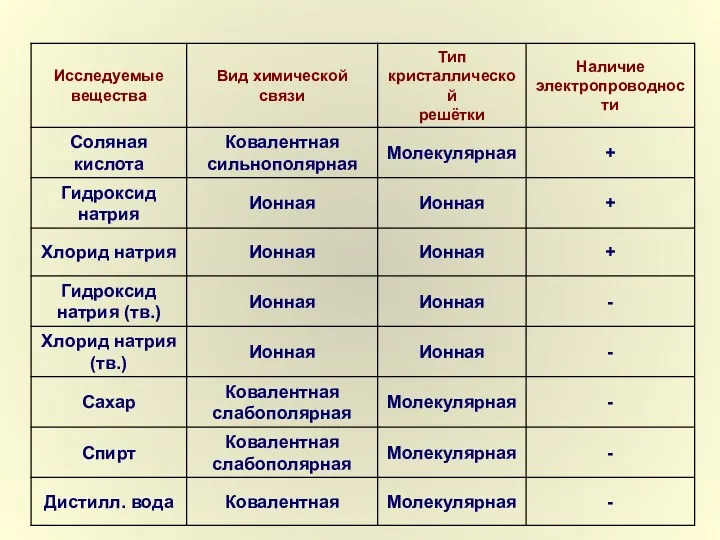
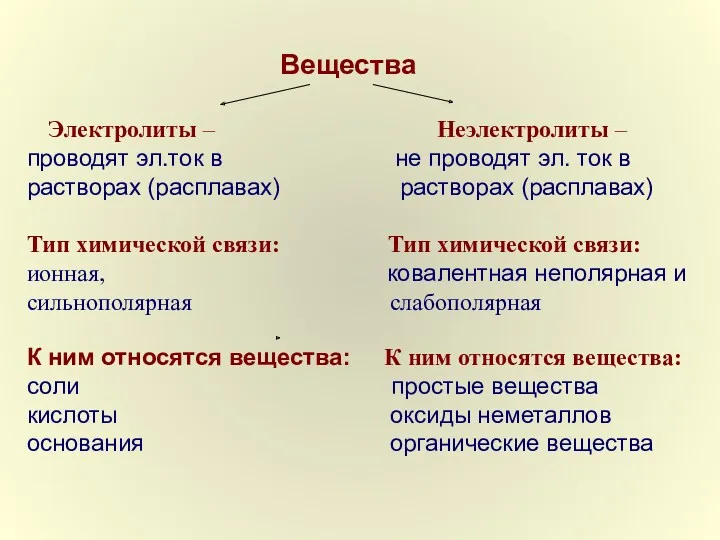
- 4. Вещества Электролиты – Неэлектролиты – проводят эл.ток в не проводят эл. ток в растворах (расплавах) растворах
- 5. Один из основоположников физической химии. Основные работы посвящены учению о растворах и кинетике химических реакций. На
- 6. Процесс распада электролита на ионы при растворении или расплавлении называется электролитической диссоциацией.
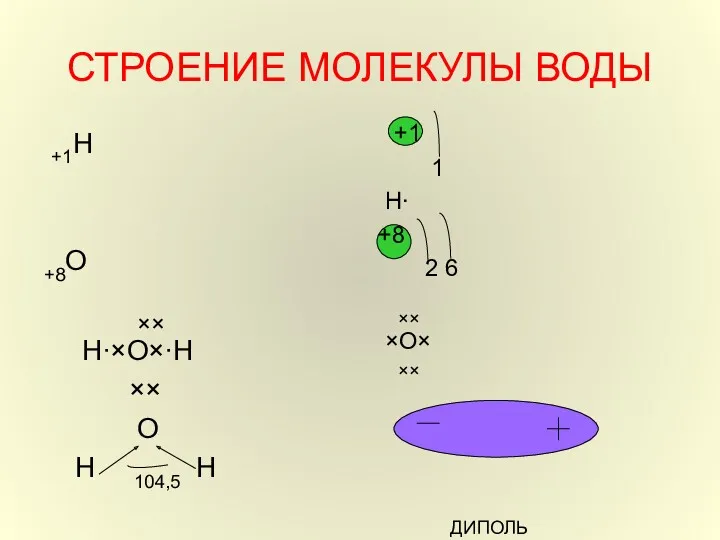
- 7. СТРОЕНИЕ МОЛЕКУЛЫ ВОДЫ +1Н +8О ×× Н∙×О×∙Н ×× О Н 104,5 Н +1 1 Н∙ +8
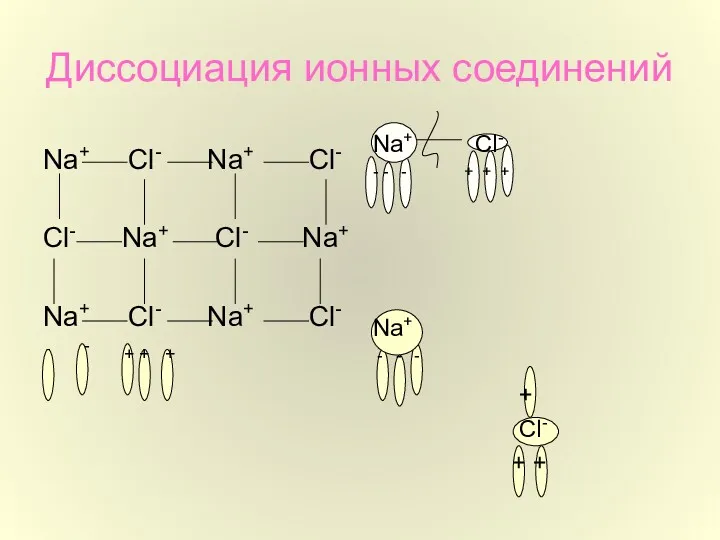
- 8. Диссоциация ионных соединений Na+ Cl- Na+ Cl- Cl- Na+ Cl- Na+ Na+ Cl- Na+ Cl- -
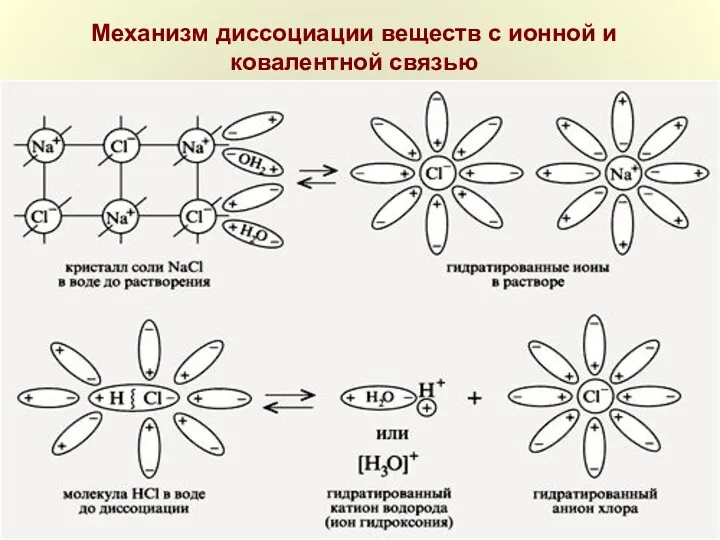
- 9. Механизм диссоциации веществ с ионной и ковалентной связью
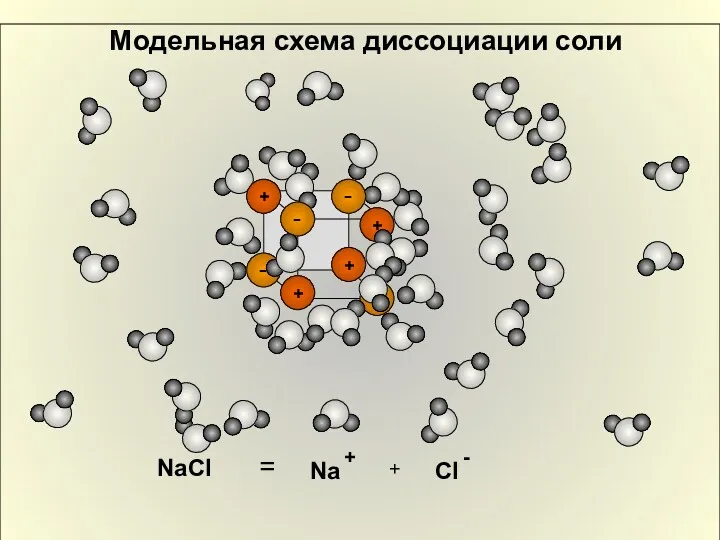
- 10. Модельная схема диссоциации соли NaCl = + Na +
- 11. Степень электролитической диссоциации NА ( число диссоциированных молекул) α = ─────────────────────────── N ( общее число молекул)
- 12. Задание 1: Впишите недостающие слова: Все вещества по их способности проводить электрический ток в растворах делятся
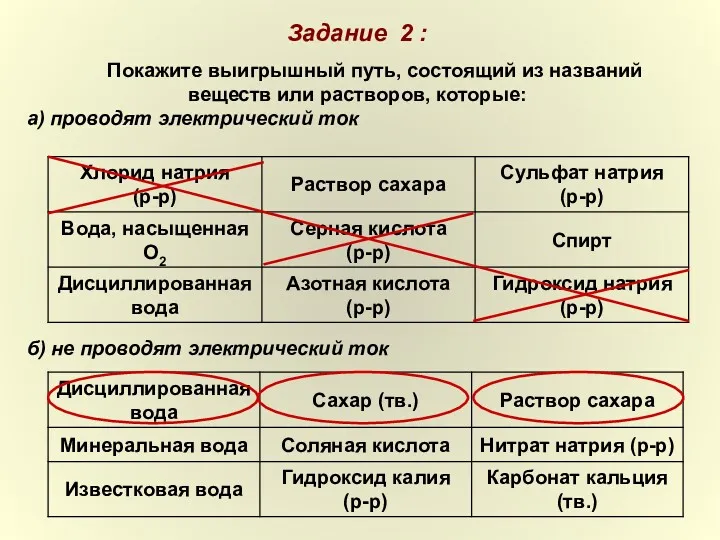
- 13. Задание 2 : Покажите выигрышный путь, состоящий из названий веществ или растворов, которые: а) проводят электрический
- 14. в) являются сильными электролитами
- 15. Задание 3: Соотнесите: 1. А) Электролиты 1) Кислоты Б) Неэлектролиты 2) Оксиды 3) Простые вещества 4)
- 17. Скачать презентацию







 Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов 20231113_tipy_him._reaktsiy_prezentatsiya
20231113_tipy_him._reaktsiy_prezentatsiya Физико-химические свойства поливинилового спирта и поливинилформаля
Физико-химические свойства поливинилового спирта и поливинилформаля Введение в общеобразовательную научную дисциплину Химия
Введение в общеобразовательную научную дисциплину Химия Наглядное пособие Динамические модели. Химическое равновесие в растворах
Наглядное пособие Динамические модели. Химическое равновесие в растворах Total Synthesis of Aplysiasecosterol A
Total Synthesis of Aplysiasecosterol A Химико-лесной комплекс
Химико-лесной комплекс Металлы в организме человека
Металлы в организме человека Тепловой эффект химических реакций
Тепловой эффект химических реакций Полімери. Будова і властивості полімерів
Полімери. Будова і властивості полімерів Көпатомды спирттер. Химиялық қасиеттері
Көпатомды спирттер. Химиялық қасиеттері Занимательные опыты в качественном анализе
Занимательные опыты в качественном анализе Атомы и молекулы. Простые и сложные вещества. 6 класс
Атомы и молекулы. Простые и сложные вещества. 6 класс Пниктогены - элеметны VA группы
Пниктогены - элеметны VA группы Соли. Классификация. Физические и химические свойства солей
Соли. Классификация. Физические и химические свойства солей Теория электролитической диссоциации
Теория электролитической диссоциации Производство чугуна и стали
Производство чугуна и стали Основания. 8 класс
Основания. 8 класс Каталитические процессы нефтепереработки
Каталитические процессы нефтепереработки Строение атома. Лекция №2
Строение атома. Лекция №2 Карбоновые кислоты. Тест
Карбоновые кислоты. Тест Сплавы, растворы и смеси. Задачи на концентрвцию
Сплавы, растворы и смеси. Задачи на концентрвцию АТФ молекуласының құрылысы мен қызметтері
АТФ молекуласының құрылысы мен қызметтері Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс)
Периодический закон и периодическая система химических элементов Д.И. Менделеева (8 класс) Спирты. Действие этанола на организм человека (10 класс)
Спирты. Действие этанола на организм человека (10 класс) Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Електроліти в сучасних акумуляторах
Електроліти в сучасних акумуляторах Химия воды
Химия воды