Содержание
- 2. Основания- сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксогруппами -ОН.
- 3. Общая формула оснований: Ме(ОН)n, Где Ме - металл n-число гидроксогрупп и одновременно валентность металла.
- 4. Номенклатура оснований Название оснований= Гидроксид + название металла в родительном падеже + валентность римскими цифрами (переменная)
- 5. Номенклатура оснований
- 6. Дайте названия гидроксидам: Ba(OH)2 Fe(OH)2 Al(OH)3 NaOH
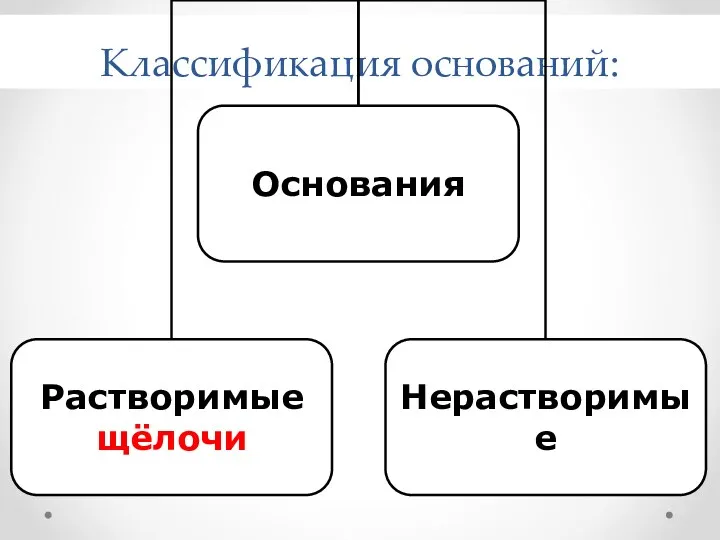
- 7. Классификация оснований:
- 8. Классификация оснований Растворимые в воде (щелочи) Нерастворимые в воде NaOH Ca(OH)2 Fe(OH)3 Сu(OH)2
- 9. Определите к какой группе относятся соединения NaOH, Mg(OH)2, RbOH, Ba(OH)2, Ni(OH)2, Cu(OH)2, Cr(OH)3
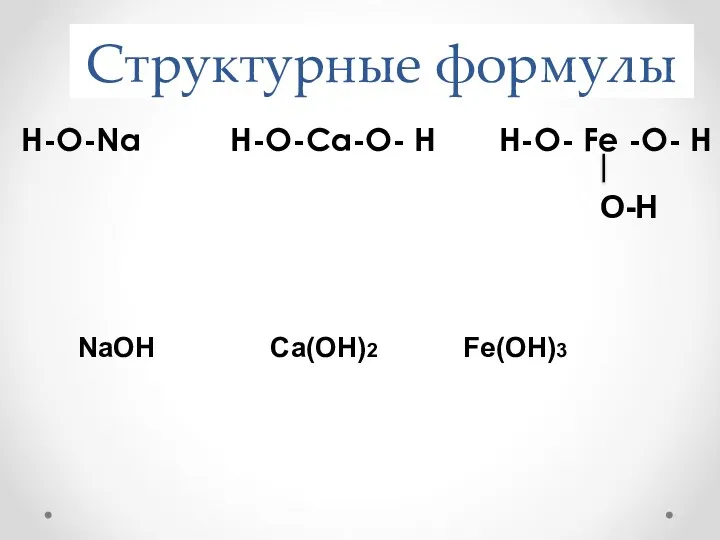
- 10. Структурные формулы Н-О-Na Н-О-Ca-О- Н Н-О- Fe -О- Н NaOH Ca(OH)2 Fe(OH)3 O-H
- 11. Физические свойства Основания - твердые кристаллические вещества. Отношение к воде- Цвет
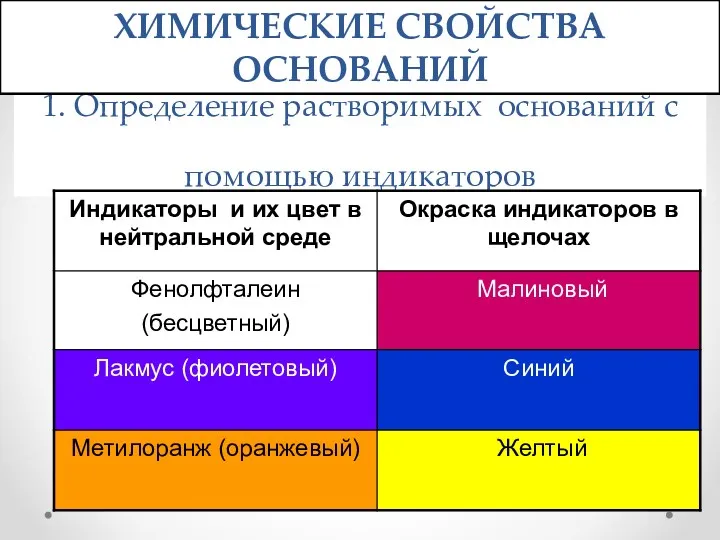
- 12. 1. Определение растворимых оснований с помощью индикаторов ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ
- 14. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 2.Взаимодействие с кислотами Основание+кислота=соль+вода KOH+HCl=KCl+H2O Cu(OH)2+2HCl=CuCl2+2H2O
- 15. Взаимодействие с кислотами: 2NaOH + H2SO4 → Na2SO4 + 2H2O реакция нейтрализации
- 16. Cu(OH)2↓+ H2SO4 →…+…
- 17. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 3.Взаимодействие с кислотными оксидами Щелочь + кислотный оксид=соль+вода 2KOH+CO2=K2CO3+H2O
- 18. Взаимодействие с кислотными оксидами Са(ОН)2 + СО2 → …+ … реакция обмена
- 19. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 4.Взаимодействие с амфотерными оксидами Щелочь+ амфотерный оксид=соль+вода 2KOH+ZnO=K2ZnO2+H2O
- 20. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 5.Взаимодействие с солями, если образуется малорастворимая соль или малорастворимое основание!!! Щелочь+соль1= нерастворимое основание
- 21. CuSO4 + NaOH→…+ … FeCl3 + NaOH→…+ …
- 22. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 6.При нагревании разлагаются нерастворимые основания (кроме LiOH): Cu (OH)2 = CuO+H2O Только для
- 23. Отношение оснований к нагреванию Fe(OH)2 → …+ … t
- 24. ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ 7. Амфотерные гидроксиды Al(OH)3, Zn(OH)2, Be(OH)2, Fe(OH)3 и другие взаимодействуют с кислотами Zn
- 25. Задание Не является щёлочью : 1)NaOH; 2)Ca(OH)2; 3)Mg(OH)2; 4)KOH.
- 26. Вопросы Что такое основание? Классификация Щелочь-это Номенклатура Химические свойства щелочей и нерастворимых оснований Способы получения оснований
- 31. Тест 1. Формулы только оснований приведены в ряду 1) Na2CO3, NaOH, NaCl 3) KОН, Mg(OH)2, Cu(OH)2
- 33. Скачать презентацию











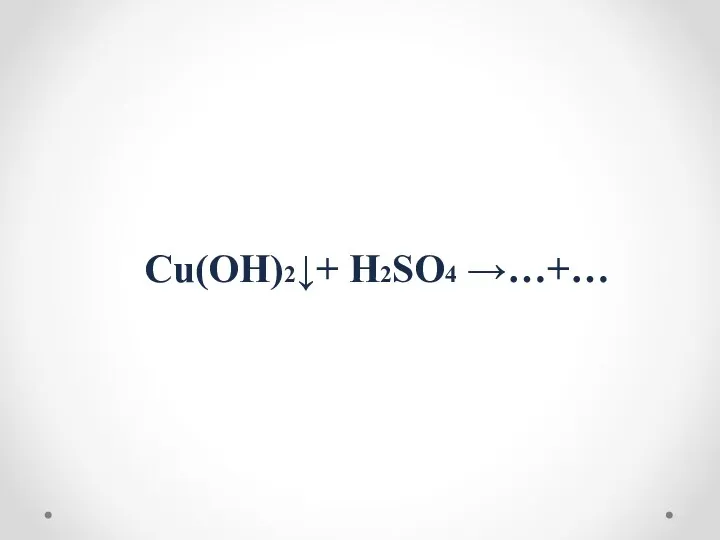















 Газовые смеси
Газовые смеси Химическая связь
Химическая связь Дәріс тақырыбы: Кіріспе. Аналитикалық химия пәні. Сапалық талдау әдістері
Дәріс тақырыбы: Кіріспе. Аналитикалық химия пәні. Сапалық талдау әдістері Стереографическая проекция. Ориентация кристаллов высшей категории
Стереографическая проекция. Ориентация кристаллов высшей категории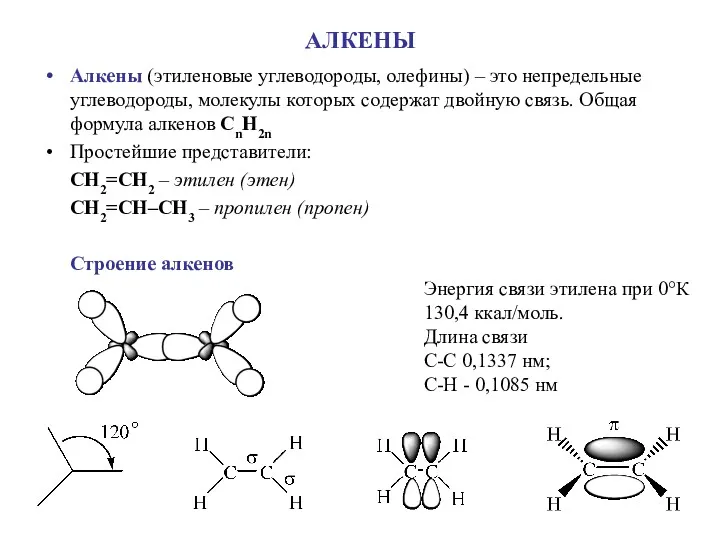 Алкены (этиленовые углеводороды, олефины)
Алкены (этиленовые углеводороды, олефины) Азотная кислота
Азотная кислота Расчеты по химическим уравнениям
Расчеты по химическим уравнениям Кислоты. Классификация кислот
Кислоты. Классификация кислот Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки
Окислительно-восстановительное титрование. Перманганатометрия. Кривые титрования, ошибки Периодический закон и периодическая система Д.И. Менделеева. 9 класс
Периодический закон и периодическая система Д.И. Менделеева. 9 класс Sm-Nd метод
Sm-Nd метод Природній та супутній нафтові гази, їх склад, використання
Природній та супутній нафтові гази, їх склад, використання Химия металлов: влияние металлов на организм человека
Химия металлов: влияние металлов на организм человека 20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii
20230321_obobshchenie_po_elektroliticheskoy_dissotsiatsii Олимпиада по учебной дисциплине. Химия
Олимпиада по учебной дисциплине. Химия Современные конструкционные материалы
Современные конструкционные материалы Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1
Периодический закон и периодическая система Д.И. Менделеева. Вторичная периодичность. Тема №1 Исследование снежного покрова
Исследование снежного покрова Типы расчетных задач, способы их решения. Задания 39-40
Типы расчетных задач, способы их решения. Задания 39-40 Значение органической химии в жизни человека
Значение органической химии в жизни человека Силикат өнеркəсібі
Силикат өнеркəсібі Прикладная химия. Теплоперенос в химических реакторах и теплообменники
Прикладная химия. Теплоперенос в химических реакторах и теплообменники Окислительно-восстановительные реакции. Генетический ряд кальция
Окислительно-восстановительные реакции. Генетический ряд кальция Теоретические основы и технология первичной переработки нефти. Тема 4
Теоретические основы и технология первичной переработки нефти. Тема 4 Щелочной металл натрий
Щелочной металл натрий Химия и повседневная жизнь человека
Химия и повседневная жизнь человека Полимеры. Каучук
Полимеры. Каучук Хімічні властивості кисню
Хімічні властивості кисню