Содержание
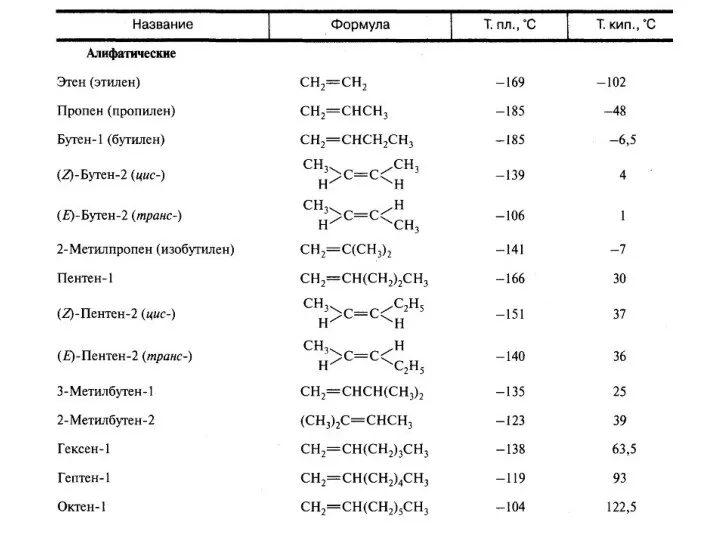
- 2. Номенклатура алкенов Названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем
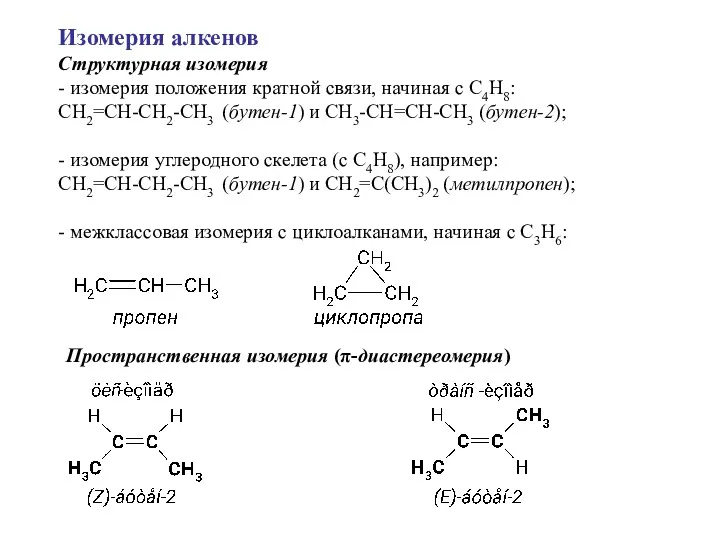
- 3. Изомерия алкенов Структурная изомерия - изомерия положения кратной связи, начиная с С4H8: СH2=CH-CH2-CH3 (бутен-1) и СH3-CH=CH-CH3
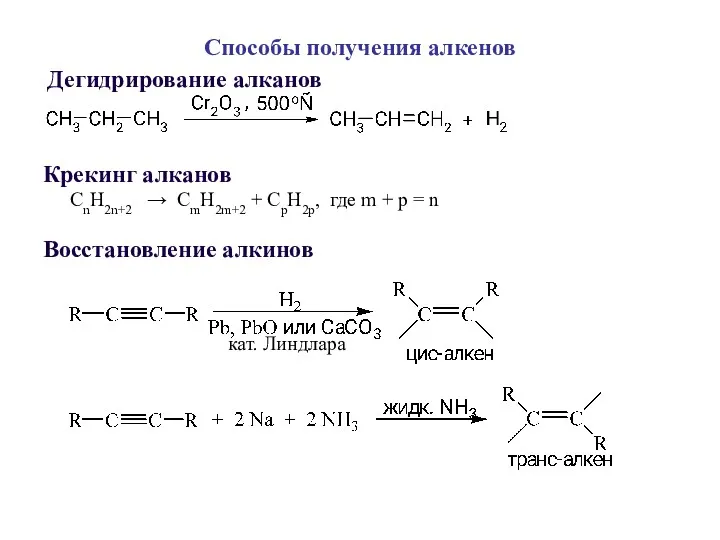
- 4. Способы получения алкенов Дегидрирование алканов Крекинг алканов CnH2n+2 → CmH2m+2 + CpH2p, где m + p
- 5. Дегалогенирование дигалогеналканов Дегидрогалогенирование галогеналканов при действии спиртового раствора щелочи
- 6. Направление реакции дегидрогалогенирования определяется относительными скоростями конкурирующих реакций. Относительная скорость образования алкенов: Реакционная способность алкилгалогенидов уменьшается
- 7. Механизм дегидрогалогенирования Е1 Механизм дегидрогалогенирования Е2 Откуда берется энергия для разрыва связи С-Н и С-Hal? За
- 8. Дегидратация спиртов при нагревании с концентрированной серной кислотой
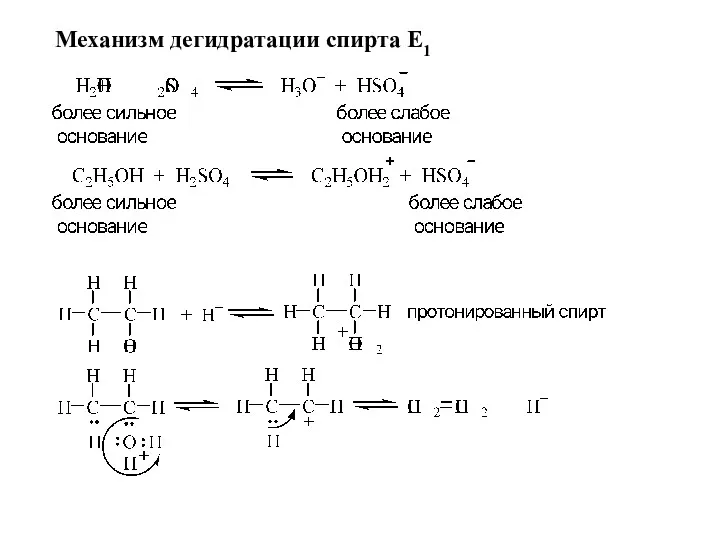
- 9. Механизм дегидратации спирта Е1
- 10. Образование карбониевого иона по механизму Е1 происходит в результате отщепления воды от протонированного спирта. Это энергетически
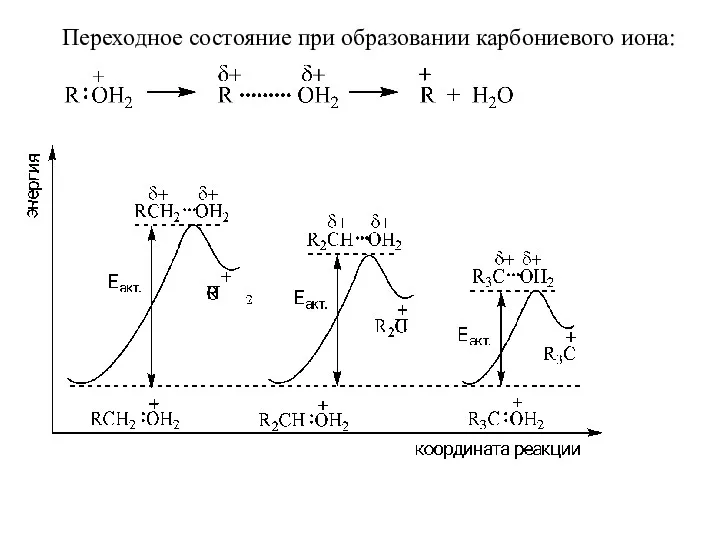
- 11. Переходное состояние при образовании карбониевого иона:
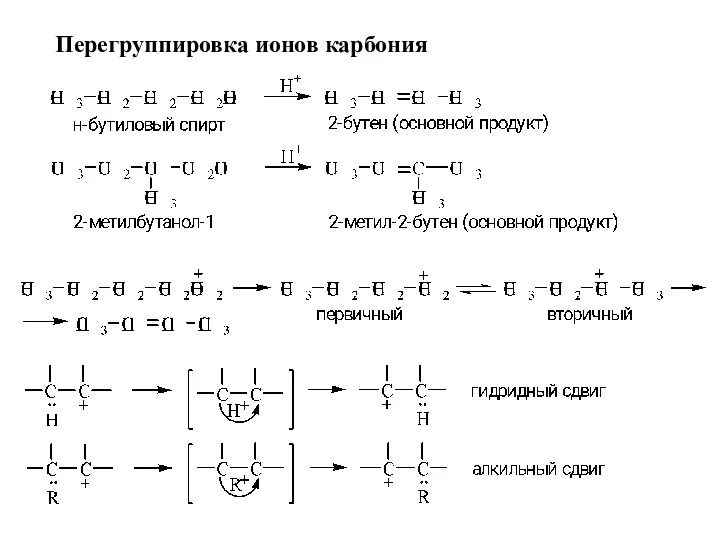
- 12. Перегруппировка ионов карбония
- 13. Правило Зайцева: В реакции β-элиминирования группы НХ атом водорода отщепляется преимущественно от наименее гидрогенизированного атома углерода.
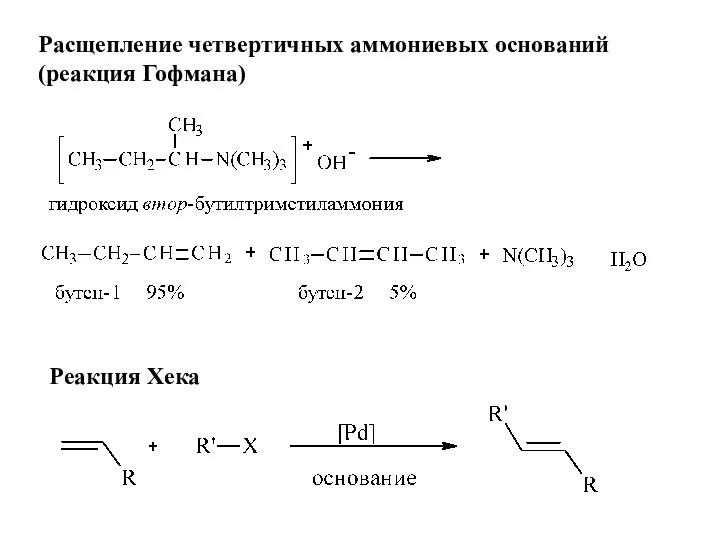
- 14. Расщепление четвертичных аммониевых оснований (реакция Гофмана) Реакция Хека
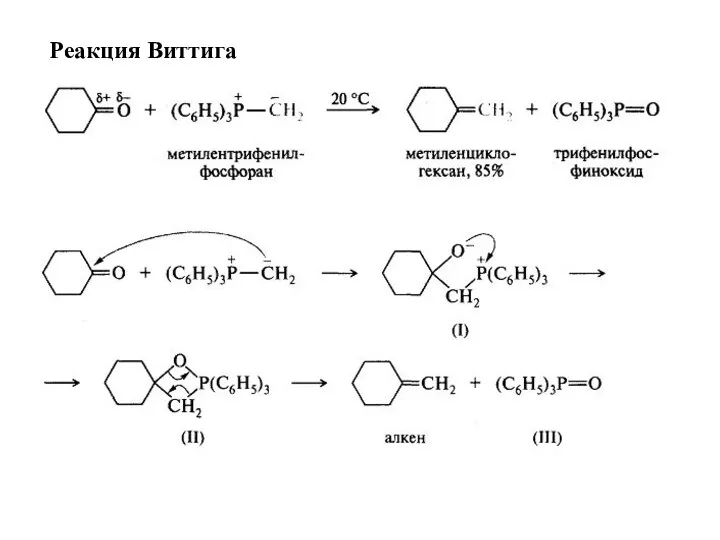
- 15. Реакция Виттига
- 17. Химические свойства алкенов Реакции присоединения
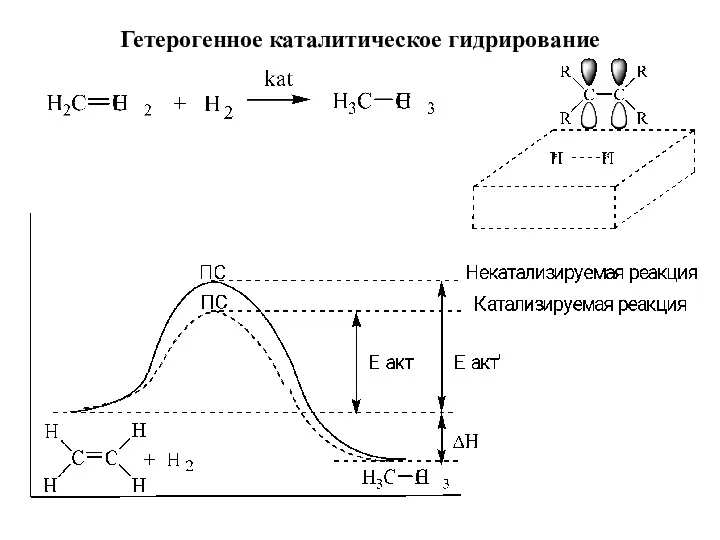
- 18. Гетерогенное каталитическое гидрирование
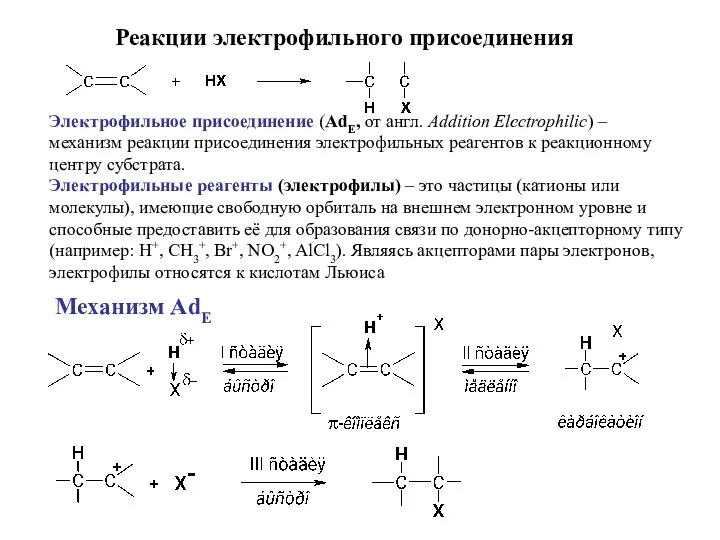
- 19. Электрофильное присоединение (АdЕ, от англ. Addition Electrophilic) – механизм реакции присоединения электрофильных реагентов к реакционному центру
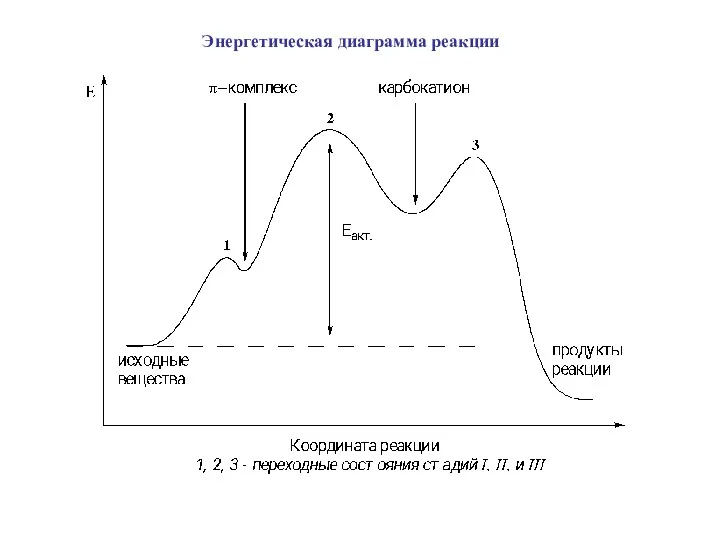
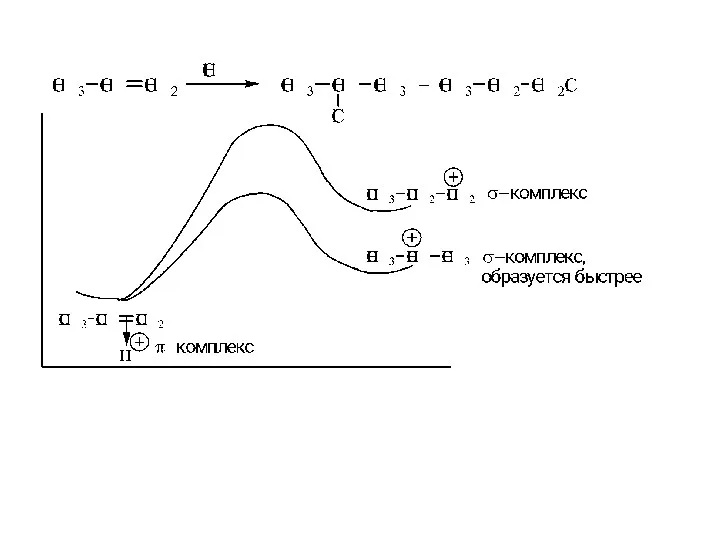
- 20. Энергетическая диаграмма реакции
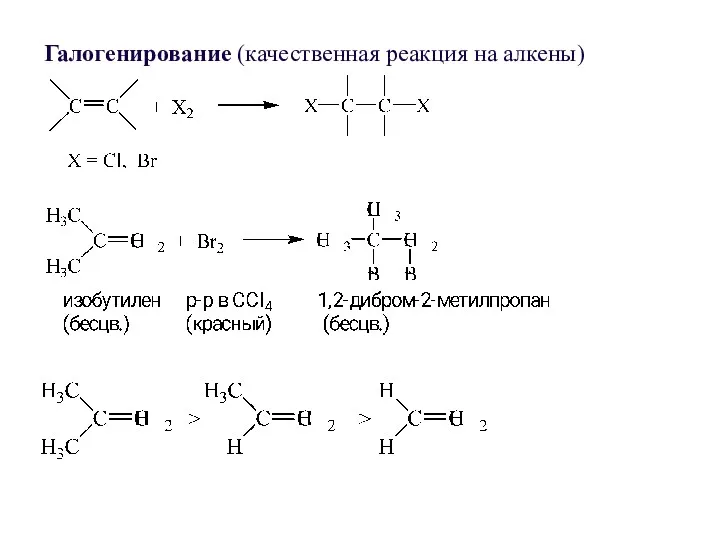
- 21. Галогенирование (качественная реакция на алкены)
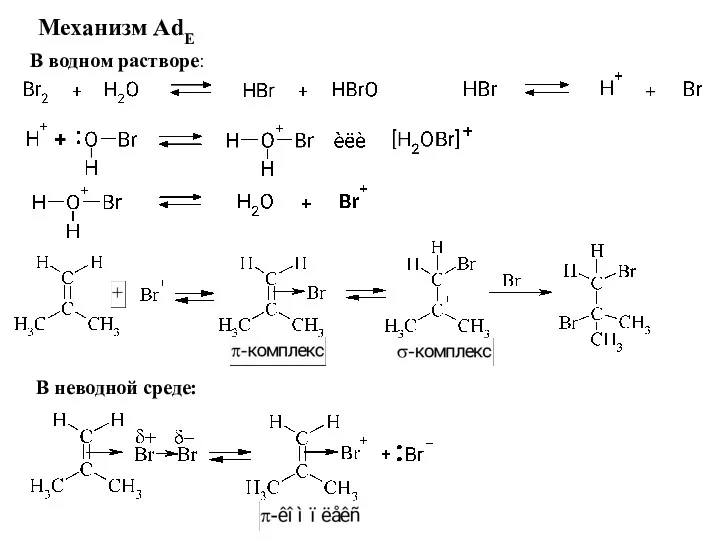
- 22. Механизм AdE В водном растворе: В неводной среде:
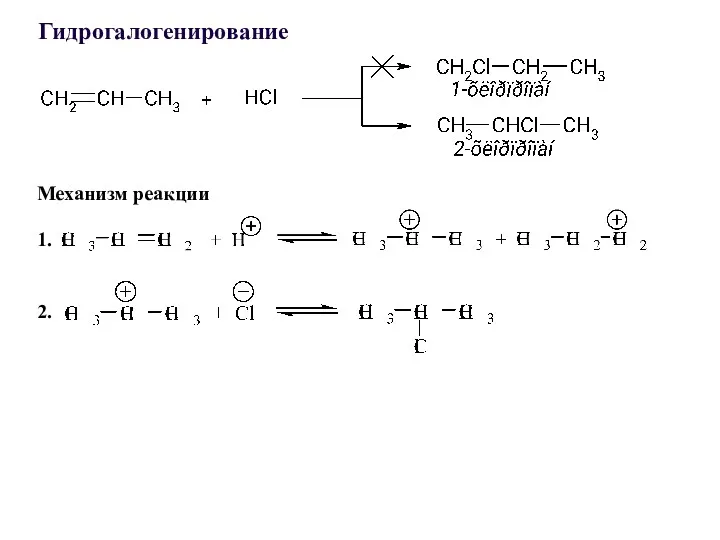
- 23. Гидрогалогенирование Механизм реакции 1. 2.
- 25. Реакция идет региоселективно по правилу Марковникова: в реакциях присоединения полярных молекул НХ к несимметричным алкенам водород
- 26. Присоединение против правила Марковникова Заместитель при двойной связи оттягивает электронную плотность на себя, т.е. проявляет электроноакцепторные
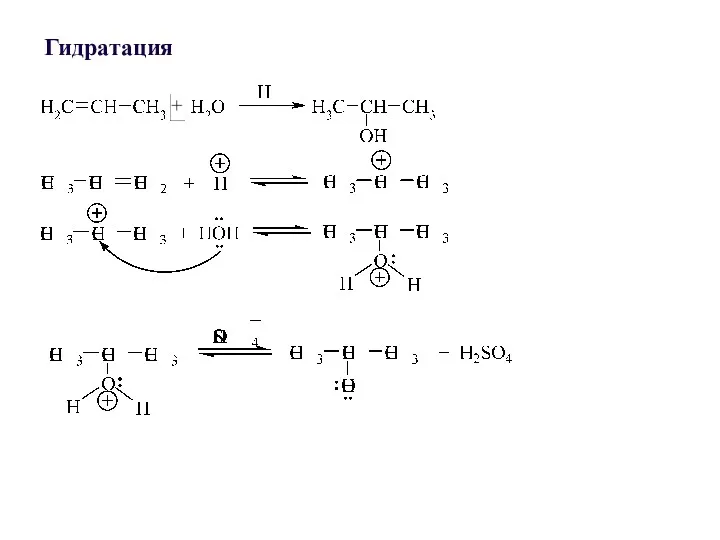
- 27. Гидратация
- 28. Присоединение серной кислоты Присоединение хлорноватистой кислоты
- 29. Реакции радикального присоединения Галогенирование алкенов на свету Активность галогенов в реакции: Cl2 > Br2 > I2
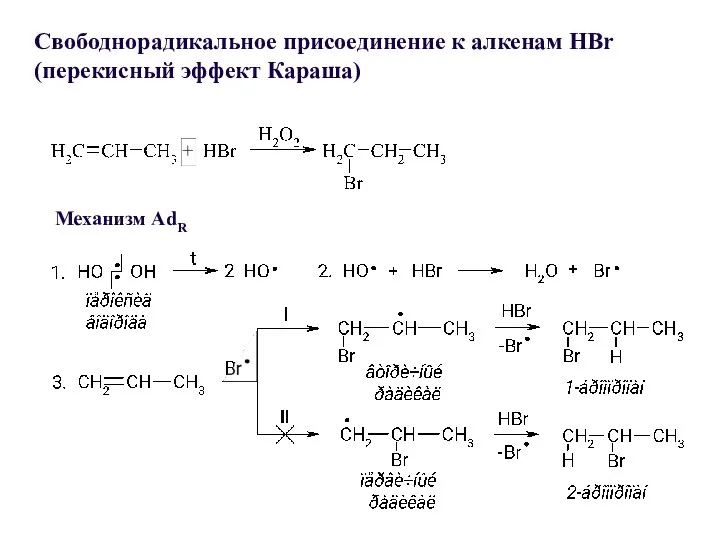
- 30. Механизм АdR Свободнорадикальное присоединение к алкенам HBr (перекисный эффект Караша)
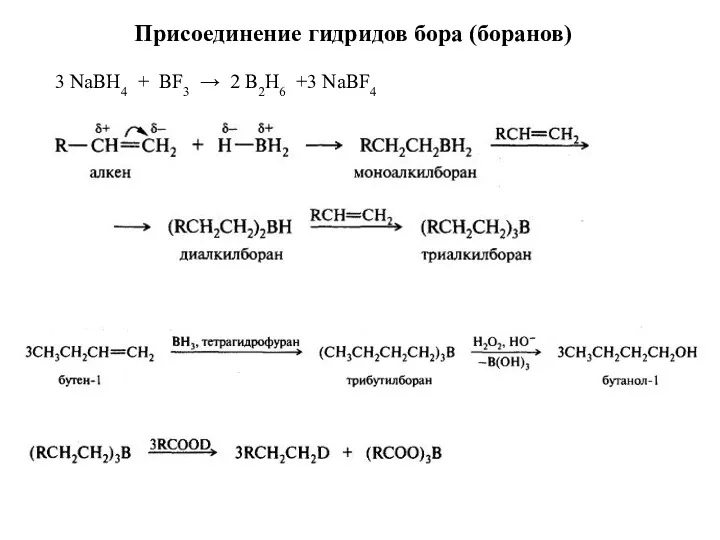
- 31. Присоединение гидридов бора (боранов) 3 NaBH4 + BF3 → 2 B2H6 +3 NaBF4
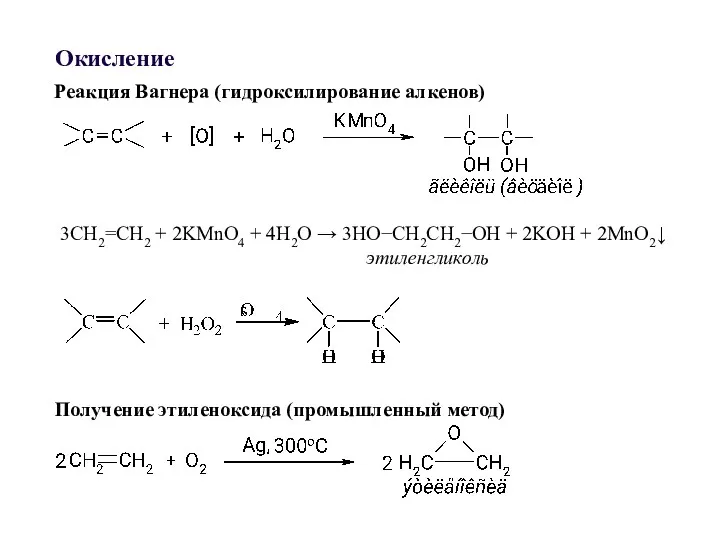
- 32. Окисление Реакция Вагнера (гидроксилирование алкенов) 3СН2=СН2 + 2KMnO4 + 4H2O → 3HO−CH2CH2−OH + 2KOH + 2MnO2↓
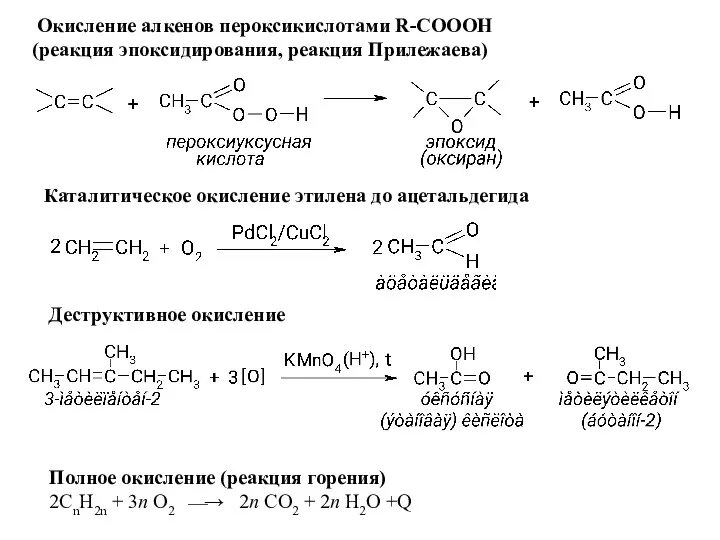
- 33. Окисление алкенов пероксикислотами R-COOOH (реакция эпоксидирования, реакция Прилежаева) Каталитическое окисление этилена до ацетальдегида Деструктивное окисление Полное
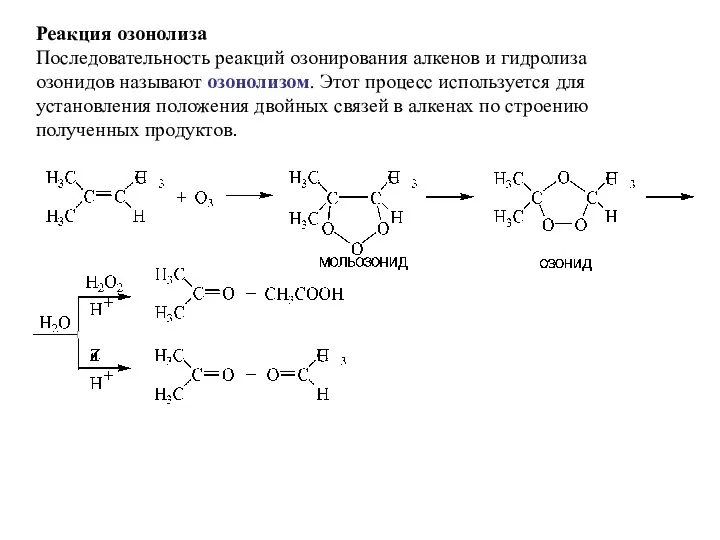
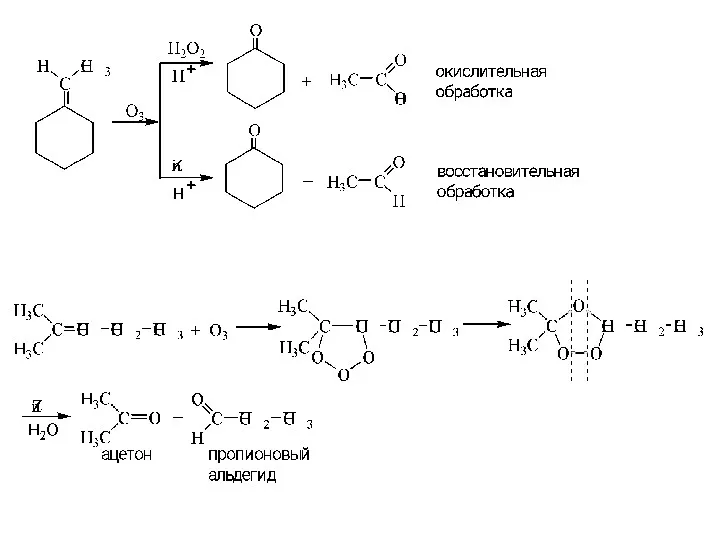
- 34. Реакция озонолиза Последовательность реакций озонирования алкенов и гидролиза озонидов называют озонолизом. Этот процесс используется для установления
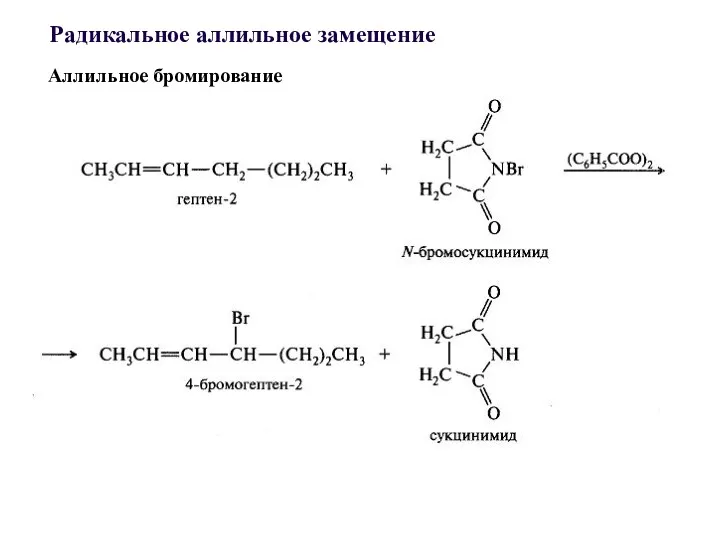
- 36. Аллильное бромирование Радикальное аллильное замещение
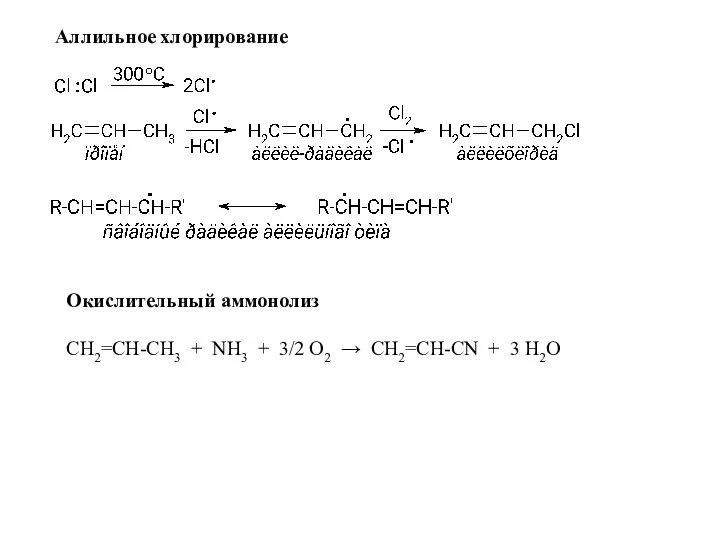
- 37. Аллильное хлорирование Окислительный аммонолиз СН2=СН-СН3 + NH3 + 3/2 O2 → СН2=СН-СN + 3 H2O
- 39. Скачать презентацию












 Процессы природного минералообразования. Формы природных выделений минералов
Процессы природного минералообразования. Формы природных выделений минералов Химический элемент титан
Химический элемент титан Химическая термодинамика
Химическая термодинамика Обзор электродных процессов
Обзор электродных процессов Азотсодержащие органические соединения
Азотсодержащие органические соединения
 Никель – тяжелый металл
Никель – тяжелый металл Хром. Строение атома
Хром. Строение атома ЕГЭ по химии. Решение задач 27, 28, 29
ЕГЭ по химии. Решение задач 27, 28, 29 Технология производства бутилкаучука
Технология производства бутилкаучука Катализ кислотами и основаниями. Лекция 3
Катализ кислотами и основаниями. Лекция 3 Силикатное производство
Силикатное производство серная кислота и ее соли 9 класс
серная кислота и ее соли 9 класс Химическая кинетика
Химическая кинетика Арены - ароматические соединения
Арены - ароматические соединения Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза
Электролиз растворов. Применение вытеснительного ряда металлов для прогнозирования продуктов электролиза Склад та властивості основних класів неорганічних сполук
Склад та властивості основних класів неорганічних сполук Воздух, которым мы дышим
Воздух, которым мы дышим Жуғыш заттардың адам өміріндегі маңызы
Жуғыш заттардың адам өміріндегі маңызы Строение и свойства атомов в свете квантовомеханической теории. Периодический закон – основа основ химии
Строение и свойства атомов в свете квантовомеханической теории. Периодический закон – основа основ химии Измерение и оценка химического фактора. Лекция 9
Измерение и оценка химического фактора. Лекция 9 Коррозия металлов
Коррозия металлов Неметаллы. Общая характеристика неметаллов
Неметаллы. Общая характеристика неметаллов Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю
Заходи з ліквідації наслідків хімічної небезпечної надзвичайної ситуації. Особливості ведення хімічної розвідки та контролю Периодическая система Д. И. Менделеева
Периодическая система Д. И. Менделеева Кислород. Открытие кислорода
Кислород. Открытие кислорода Lipid metabolism
Lipid metabolism Алканы: физические и химические свойства, получение
Алканы: физические и химические свойства, получение