Содержание
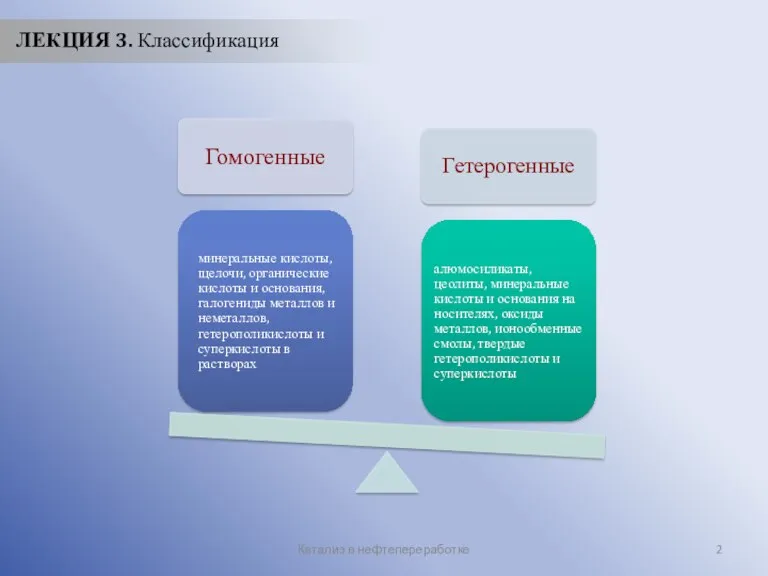
- 2. Катализ в нефтепереработке ЛЕКЦИЯ 3. Классификация
- 3. Катализ в нефтепереработке ЛЕКЦИЯ 3. Определение кислоты и основания AH и B – сопряженные кислота и
- 4. Катализ в нефтепереработке ЛЕКЦИЯ 3. Определение кислотности а) Сила протонной кислоты: б) Кислотность разбавленных протонных кислот:
- 5. Катализ в нефтепереработке ЛЕКЦИЯ 3. Свойства протона Сверхмалый размер и масса; Способность образовывать водородные связи. Следствия:
- 6. Катализ в нефтепереработке ЛЕКЦИЯ 3. Принципы действиия Уравнение Бренстеда (эмпирическое правило): – для общего кислотного катализа
- 7. Катализ в нефтепереработке ЛЕКЦИЯ 3. Механизм катализа Протонирование реагента приводит к появлению положительного заряда и сильной
- 8. Катализ в нефтепереработке ЛЕКЦИЯ 3. Механизм катализа Согласованный механизм Туннельный механизм Сильная температурная зависимость
- 9. Катализ в нефтепереработке ЛЕКЦИЯ 3. Ключевые стадии π - комплекс карбениевый ион Реакции карбениевого иона:
- 10. Катализ в нефтепереработке ЛЕКЦИЯ 3. Катализ кислотами и основаниями Льюиса Кислоты: Al(III); AlCl3; AlBr3; AlF3; ZnCl2;
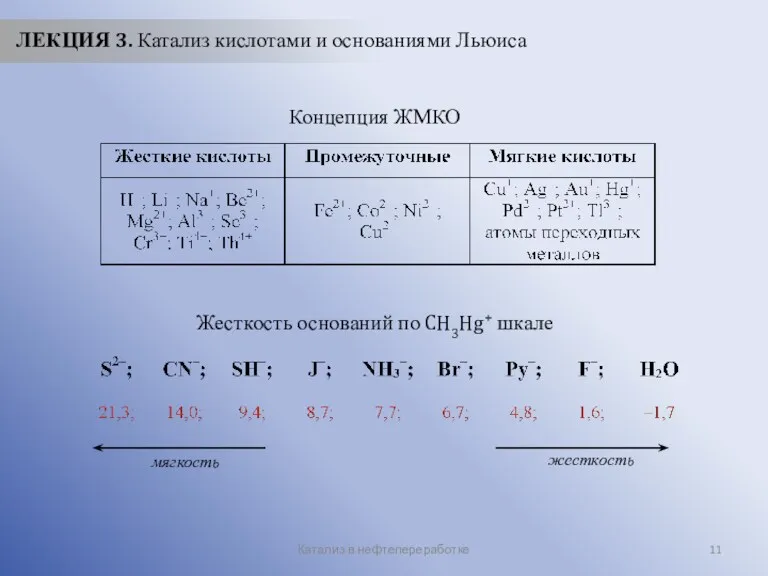
- 11. Катализ в нефтепереработке ЛЕКЦИЯ 3. Катализ кислотами и основаниями Льюиса Концепция ЖМКО Жесткость оснований по CH3Hg+
- 12. Катализ в нефтепереработке ЛЕКЦИЯ 3. Катализ кислотами и основаниями Льюиса Связь между активностью и силой льюисовских
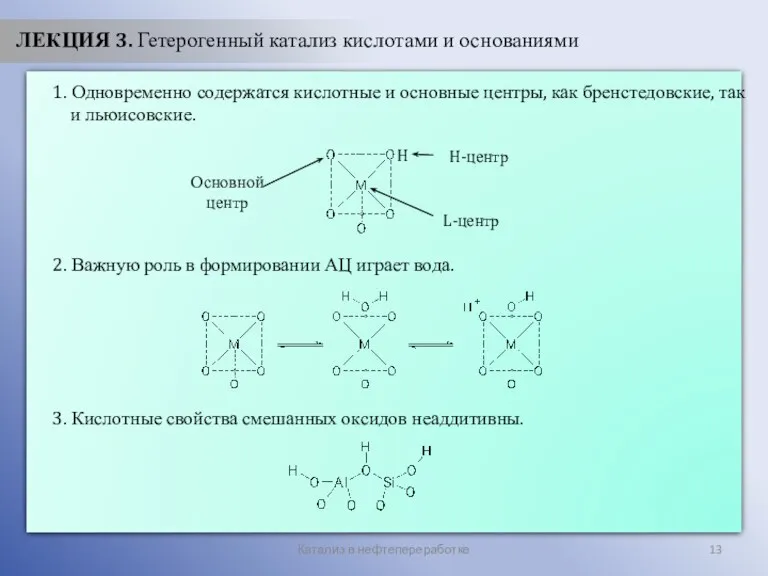
- 13. Катализ в нефтепереработке ЛЕКЦИЯ 3. Гетерогенный катализ кислотами и основаниями 1. Одновременно содержатся кислотные и основные
- 14. Катализ в нефтепереработке ЛЕКЦИЯ 3. Гетерогенный катализ кислотами и основаниями 4. Большие возможности изменения кислотно-основных свойств
- 15. Катализ в нефтепереработке ЛЕКЦИЯ 3. Гетерогенный катализ кислотами и основаниями 5. При определении количества и силы
- 16. Катализ в нефтепереработке ЛЕКЦИЯ 3. Закономерности гетерогенного КО катализа Минимальная сила протонных центров, необходимая для некоторых
- 18. Скачать презентацию












 Типичные окислители
Типичные окислители Количество вещества. 8 класс
Количество вещества. 8 класс Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Основания. Классификация оснований
Основания. Классификация оснований Водородный показатель
Водородный показатель Химические свойства металлов. Взаимодействие с простыми веществами
Химические свойства металлов. Взаимодействие с простыми веществами Молярный объем газов. 8 класс
Молярный объем газов. 8 класс Использование технологии уровневой дифференциации на уроках химии
Использование технологии уровневой дифференциации на уроках химии Кристаллические решётки и их виды
Кристаллические решётки и их виды Алкалоиды, производные тропана
Алкалоиды, производные тропана Термохимия. Термохимические уравнения
Термохимия. Термохимические уравнения Общие представления о фазовых состояниях и фазовых переходах полимеров
Общие представления о фазовых состояниях и фазовых переходах полимеров фосфор и его соединения
фосфор и его соединения Эколого-химическая характеристика качества почвы
Эколого-химическая характеристика качества почвы Закон триад. Открытие периодического закона
Закон триад. Открытие периодического закона Жидкое и растворимое стекло
Жидкое и растворимое стекло Основы химической термодинамики и кинетики химических реакций
Основы химической термодинамики и кинетики химических реакций O-alkylation catalysts
O-alkylation catalysts Электролитическая диссоциация
Электролитическая диссоциация Мінеральні добрива та їх класифікація
Мінеральні добрива та їх класифікація Псевдоморфозы. Образование псевдоморфоз
Псевдоморфозы. Образование псевдоморфоз Құрамында белгілі қоспасы бар басқа заттың массасын (көлемін) реакция теңдеуі бойынша есептеу
Құрамында белгілі қоспасы бар басқа заттың массасын (көлемін) реакция теңдеуі бойынша есептеу Топырақ биоремедиациясы
Топырақ биоремедиациясы Равновесие в растворах электролитов
Равновесие в растворах электролитов Галогены. Свойства галогенов
Галогены. Свойства галогенов Ртуть
Ртуть Циклоалканы. 10 класс
Циклоалканы. 10 класс Фенолы. Классификация и номенклатура фенолов
Фенолы. Классификация и номенклатура фенолов