Содержание
- 2. Алгоритм работы. Педагогическая диагностика: определение зоны актуального и ближайшего развития; определение уровня обучаемости; определение уровня обученности.
- 3. Вариант 1. Продолжите фразу: 1. Сильные электролиты – это… 2. Из приведенного перечня выпишите слабые электролиты:
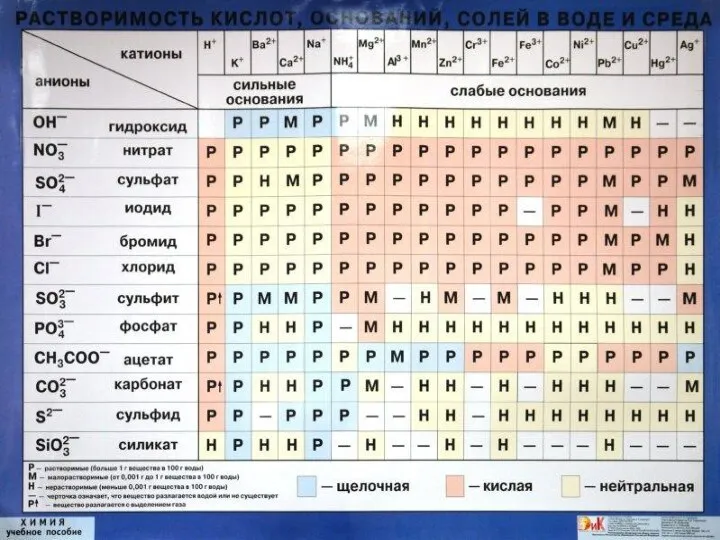
- 4. Ответы: Вариант 1 Вещества полностью диссоциирующие на ионы Cu (OH)2, H2CO3, Be(OH)2, NH4OH, CaCO3 Fe2(SO4)3, HNO3
- 5. Проблемный вопрос: В растворе электролиты существуют в виде ионов. Что происходит при сливании растворов электролитов? CuSO4
- 6. Тема урока: Реакции ионного обмена. Актуализация знаний: мы должны с вами исследовать сущность реакций ионного обмена
- 7. Цель урока: ▲ Знать об ионных реакциях, ионных уравнениях, реакции нейтрализации, условиях протекания химических реакций до
- 9. Изучение нового материала 1. NaOH + HCI = NaCI + H2O Na + + ОH- +
- 10. Задания для осознания и осмысления новой учебной информации. ▲ Репродуктивное (типовое). Закончить уравнение реакции в молекулярной
- 11. Закрепление учебного материала. Закончите предложения: Реакции между ионами называются ……………………………… (ионными) Реакция взаимодействия раствора кислоты со
- 12. Уровневое домашнее задание: ▲ Уровень 1. Вам выдан раствор BaCl₂ . Как обнаружить ионы Ba и
- 13. Рефлексия Прочитайте цели урока и определите как справились с работой, на каком уровне? Все ли понятно
- 14. Контрольная работа по теме «Электролитическая диссоциация. РИО.» (тест обученности по П.И.Третьякову) I. Выполните тест 1. Не
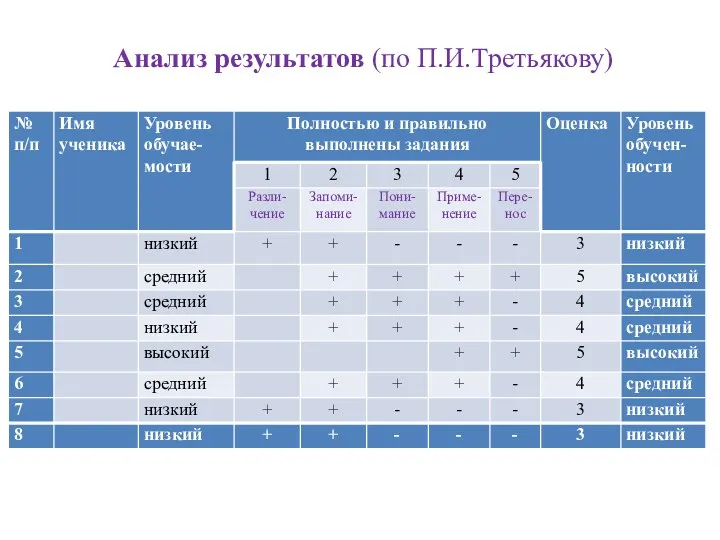
- 15. Анализ результатов (по П.И.Третьякову)
- 17. Скачать презентацию











 Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты
Биохимия. Критерии оценки косметических средств. Лекция 4. Индустрия красоты Обмен нуклеопротеинов
Обмен нуклеопротеинов Каменный уголь. Физические и химические свойства
Каменный уголь. Физические и химические свойства Изменение активности катализатора в процессе эксплуатации
Изменение активности катализатора в процессе эксплуатации Геохимия
Геохимия Электрохимические процессы
Электрохимические процессы Аммиак
Аммиак Предмет и история геохимии
Предмет и история геохимии Углеводы. (Лекция 7)
Углеводы. (Лекция 7) Предмет органической химии
Предмет органической химии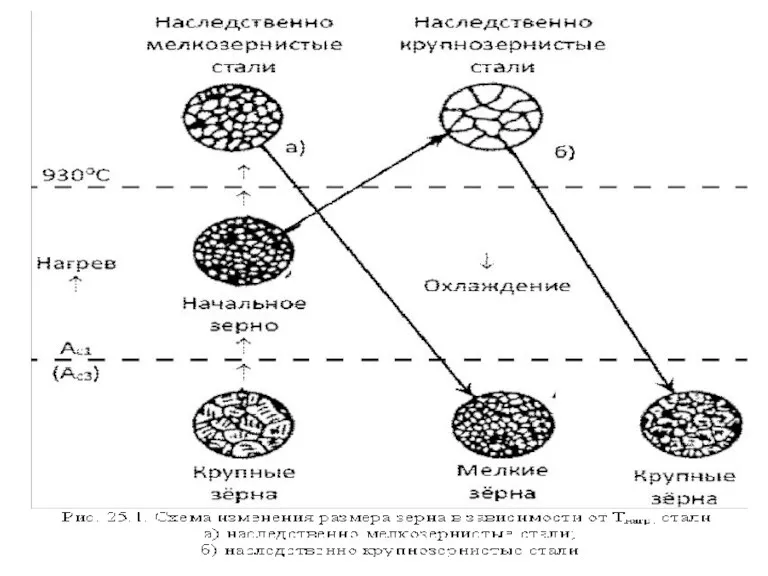 Материаловедение-2
Материаловедение-2 Лекция 3. Гидроксисоединения. Карбонильные соединения
Лекция 3. Гидроксисоединения. Карбонильные соединения Алюминий и его соединения
Алюминий и его соединения 6-я группа элементов. 9 класс
6-я группа элементов. 9 класс Оксид серы (IV) и серы (VI)
Оксид серы (IV) и серы (VI)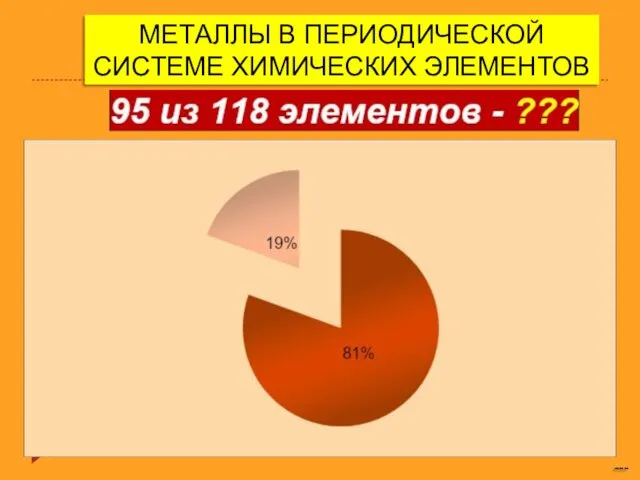 Металлы в периодической системе химических элементов
Металлы в периодической системе химических элементов Требования к осадителю
Требования к осадителю Protein Chemistry
Protein Chemistry Газообразное состояние вещества
Газообразное состояние вещества Кислоты. Состав кислот
Кислоты. Состав кислот 5.Алкины
5.Алкины Сполуки основних класів у будівництві і побуті
Сполуки основних класів у будівництві і побуті Chemical kinetics
Chemical kinetics Фенол қосылыстары
Фенол қосылыстары Кевлар. Структура кевлара
Кевлар. Структура кевлара Переработка газа. Первичная переработка нефти. Лекция 9
Переработка газа. Первичная переработка нефти. Лекция 9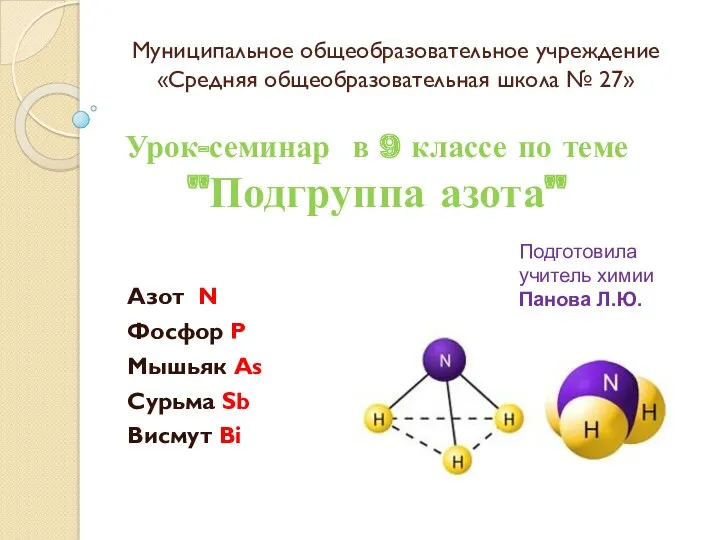 Подгруппа азота
Подгруппа азота Фосфор
Фосфор