Содержание
- 4. сильный яд, даже в малых дозах действует смертельно в твердом состоянии получается при быстром охлаждении паров
- 5. имеет формулу Рn и представляет собой полимер со сложной структурой порошок красно-бурого цвета неядовит, нелетуч нерастворим
- 6. представляет собой чёрное вещество с металлическим блеском, жирное на ощупь и весьма похожее на графит, и
- 7. Органические производные трехвалентного фосфора Органофосфины являются производными фосфина РН3, где атомы водорода замещены на органические радикалы.
- 8. Способы получения органофосфинов В случае неполного замещения образуются органохлорфосфины: Также органофосфины можно получать по реакции гидридного
- 9. Органохлорфосфины могут быть получены реакцией прямого синтеза из элементного фосфора (красного) и галогеналкила в присутствии катализатора
- 10. Химические свойства органофосфинов Низшие алифатические фосфины самовоспламеняются на воздухе. В условиях регулируемого процесса окисления триорганофосфины присоединяют
- 11. Взаимодействие хлорангидридов с водой: А из кислот этерификацией хлорангидридов органическими спиртами или их алкоголятов получают эфиры:
- 12. ОРТОФОСФОРНАЯ КИСЛОТА И ФОСФАТЫ Получение
- 13. Свойства H3PO4 — трёхосновная кислота средней силы. При взаимодействии с очень сильной кислотой, например, с хлорной
- 14. ФОСФАТЫ Соли фосфорной кислоты называются фосфатами. Фосфорная кислота образует одно-, двух- и трехзамещенные соли Дигидрофосфаты обычно
- 15. Применение фосфатов Авиационная промышленность Пищевая промышленность Сельское хозяйство Стоматология
- 16. ФОСФОНОВЫЕ КИСЛОТЫ Фосфоновые кислоты — тип фосфорсодержащих органических соединений. Общая формула R-PO(OH)2. Есть связь «углерод-фосфор». Являются
- 17. Важнейшие представители фосфоновых кислот Фосфонуксусная кислота HOOCCH2P(O)(OH)2 Нитрилометиленфосфоновая кислота Получают по схеме: NH3+3CH2O+PCl3+6H20=N[CH2P(O)(OH)2]3+9НCl Оксиэтилидендифосфорная кислота СН3С(ОН)[Р(О)(ОН)
- 18. ФОСФИНОВЫЕ КИСЛОТЫ Фосфи́новые кисло́ты — фосфорсодержащие органические соединения общей формулы R2P(=O)OH, формально являющиеся замещенными производными фосфиновой
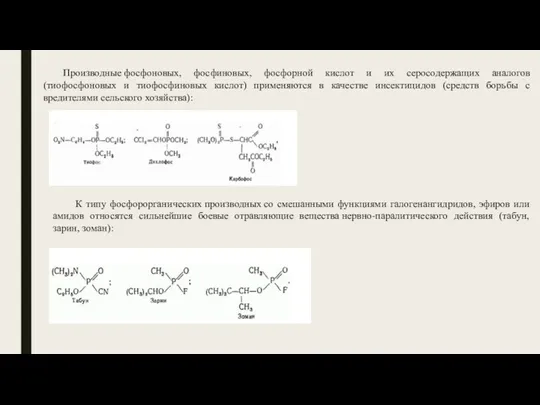
- 19. Производные фосфоновых, фосфиновых, фосфорной кислот и их серосодержащих аналогов (тиофосфоновых и тиофосфиновых кислот) применяются в качестве
- 20. Соединения, содержащие пятиковалентный фосфор, — алкилиденфосфораны могут выступать в качестве нуклеофильных реагентов в реакциях с альдегидами
- 21. ТАУТОМЕРИЯ ФОСФОРООРГАНИЧЕСКИХ СОЕДИНЕНИЙ (взаимные превращения) Многие фосфорорганические соединения склонны к обратимым изомеризациям. Чаще всего такие изомеризации
- 22. Прототропные процессы могут приводить к серьезным структурным изменениям веществ. Так, β-окси-алкилфосфиты проявляют высокую склонность переходить в
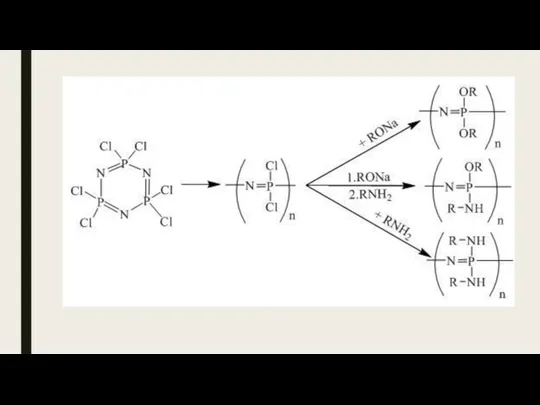
- 23. Фосвазены Фосфазены - Большой интерес для полимерной химии представляют соединения фосфора с азотом, так называемые фосфазены
- 24. Получение nPCl5 + nNH4Cl [NPCl2 )n + 4nHCl Схема реакции получения дихлоциклофосфазенов R2PCl3 + nNH4Cl (NPR2
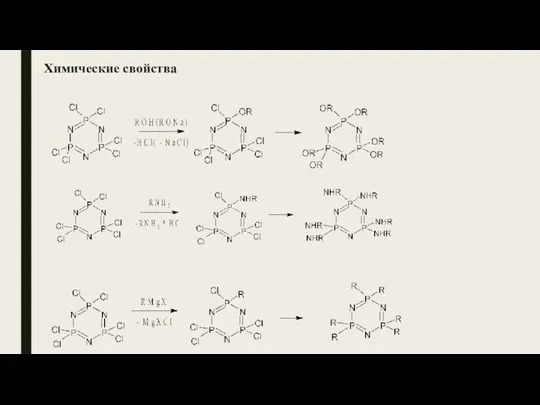
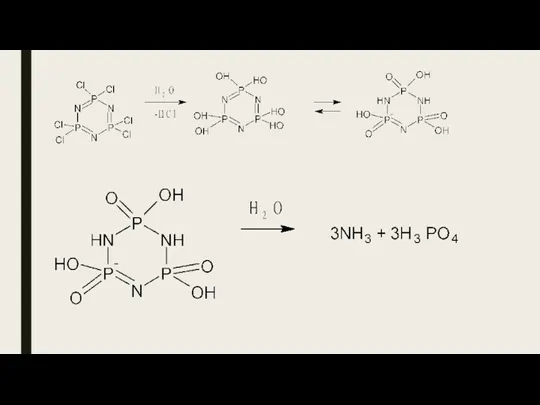
- 25. Химические свойства
- 28. Полифосфазены биомедицинского назначения синтезируют путем молекулярного замещения полидихлорофосфазена, получаемого, в свою очередь, из хлорофосфазенов, в частности
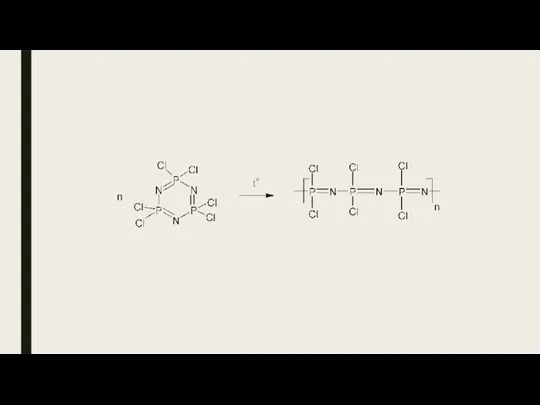
- 30. Синтез полифосфазенов Гетерополифосфазены [—N=P(R2)—X—], получают поликонденсацией хлорфосфазенов с полифункцион. фенолами и аминами (наиб. важны полифосфазены на
- 32. Скачать презентацию























![Синтез полифосфазенов Гетерополифосфазены [—N=P(R2)—X—], получают поликонденсацией хлорфосфазенов с полифункцион. фенолами](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/261721/slide-29.jpg)
 Особенности применения проблемных моделей обучения на уроках химии
Особенности применения проблемных моделей обучения на уроках химии Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6
Кристаллография и основы кристаллохимии. Закон постоянства углов. Методы проецирования кристаллов. Лекция №6 Алюминий и его соединения
Алюминий и его соединения Расчет материального и теплового баланса процесса пиролиза гексана
Расчет материального и теплового баланса процесса пиролиза гексана Неоднородные системы (процессы и аппараты химической технологии, 8 лекция)
Неоднородные системы (процессы и аппараты химической технологии, 8 лекция) Предмет аналитической химии и ее основные понятия
Предмет аналитической химии и ее основные понятия Алкадиены. Диеновые углеводороды
Алкадиены. Диеновые углеводороды Изомерия. Типы изомерии
Изомерия. Типы изомерии Химические уравнения
Химические уравнения α-Аминокислоты и белки
α-Аминокислоты и белки Відносна густина газів
Відносна густина газів Циклоалканы
Циклоалканы Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Щелочной металл натрий
Щелочной металл натрий Гидролиз. Необратимый гидролиз
Гидролиз. Необратимый гидролиз Химическая промышленность
Химическая промышленность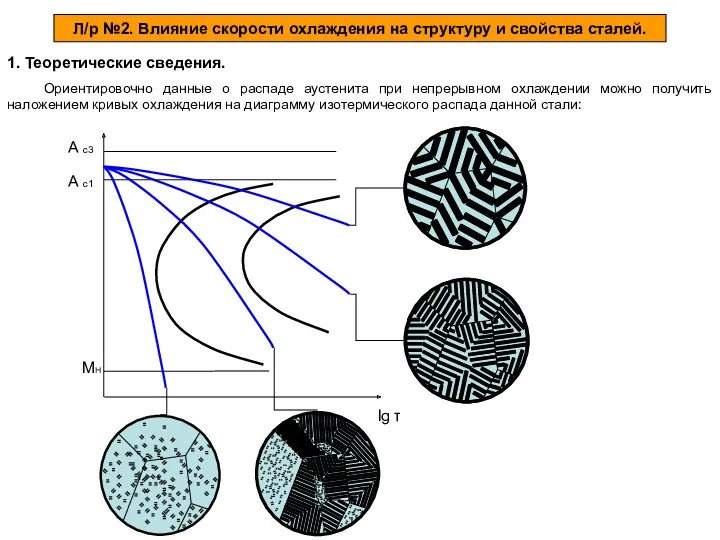 Влияние скорости охлаждения на структуру и свойства сталей
Влияние скорости охлаждения на структуру и свойства сталей Органический полимер полиэфирэфиркетон (PEEK). Использование PEEK в 3D-печати
Органический полимер полиэфирэфиркетон (PEEK). Использование PEEK в 3D-печати Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3)
Высокомолекулярные соединения и супрамолекулярные структуры. (Лекция 3) Алотропні форми Карбону
Алотропні форми Карбону Анализ галогенидов щелочных металлов
Анализ галогенидов щелочных металлов Классификация и номенклатура липидов. Жирные кислоты, их классификация и номенклатура
Классификация и номенклатура липидов. Жирные кислоты, их классификация и номенклатура Окислительно-восстановительные реакции. 11 класс
Окислительно-восстановительные реакции. 11 класс Химический элемент водород
Химический элемент водород СВОЙСТВА ЧЕРНЫХ И ЦВЕТНЫХ МЕТАЛЛОВ.
СВОЙСТВА ЧЕРНЫХ И ЦВЕТНЫХ МЕТАЛЛОВ. Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3
Общие понятия неорганической химии. Химические свойства основных классов неорганических веществ. Лекция 3 Хром. Строение атома
Хром. Строение атома Особенности химического состава клетки
Особенности химического состава клетки