Содержание
- 2. Открытие элемента Натрий – бурлящее вещество. В 1807г. Г. Дэви путём электролиза слегка увлажнённых твёрдых щёлочей
- 3. Положение в периодической системе Na расположен в третьем периоде I группы главной подгруппы.
- 4. Нахождение в природе В природе щелочные металлы в свободном виде не встречаются. Натрий входит в состав
- 5. Физические свойства Натрий - серебристо-белый металл, его плотность - 0,97 г/см3, очень мягкий, легко режется ножом.
- 6. Химические свойства 1)Взаимодействие с кислородом: 2Na + O₂ Na₂O₂ 2Na + Na₂O₂ 2Na₂O 2) Взаимодействие с
- 7. Химические свойства 3) Гидриды активно реагируют с водой: NaH + H₂O NaOH + H₂ 4) Натрий,
- 8. Химические свойства 7) Как и все щелочные металлы, натрий вступает в реакции с галогенами с образованием
- 9. Биологическая роль - поддерживает осмотическое давление и рН среды - вместе с калием формирует электрический потенциал
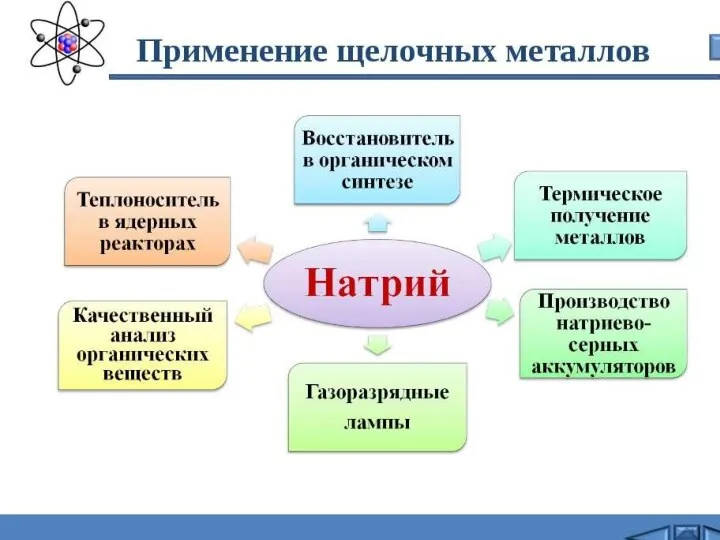
- 10. Что еще нужно знать о натрии? Натрий на воздухе легко окисляется и поэтому натрий хранят под
- 13. Скачать презентацию









 Фосфор и его соединения
Фосфор и его соединения Магматические горные породы
Магматические горные породы Фізичні та хімічні явища (гра)
Фізичні та хімічні явища (гра) Uses of chlorine and its compounds
Uses of chlorine and its compounds Гидролиз солей
Гидролиз солей Энтальпия. Тепловой эффект химической реакции. 11 класс
Энтальпия. Тепловой эффект химической реакции. 11 класс Розчини високомолекулярних сполук
Розчини високомолекулярних сполук Эндогенная серия. Магматическая группа
Эндогенная серия. Магматическая группа Диеновые углеводороды
Диеновые углеводороды Влияние состава вещества на эффективность таяния льда и замерзания водных солевых растворов
Влияние состава вещества на эффективность таяния льда и замерзания водных солевых растворов Экспериментально исследовательский проект Соль волшебница
Экспериментально исследовательский проект Соль волшебница Высокомолекулярные соединения полимеры
Высокомолекулярные соединения полимеры Геохимия стабильных изотопов, Радиоуглеродный метод
Геохимия стабильных изотопов, Радиоуглеродный метод Изомерия
Изомерия Чистые вещества и смеси. Способы разделения смесей
Чистые вещества и смеси. Способы разделения смесей Химические свойства предельных одноатомных спиртов
Химические свойства предельных одноатомных спиртов Элемент 7 группы, побочной подгруппы, d-элемент - Mn (марганец)
Элемент 7 группы, побочной подгруппы, d-элемент - Mn (марганец) Химические свойства основных классов неорганических соединений
Химические свойства основных классов неорганических соединений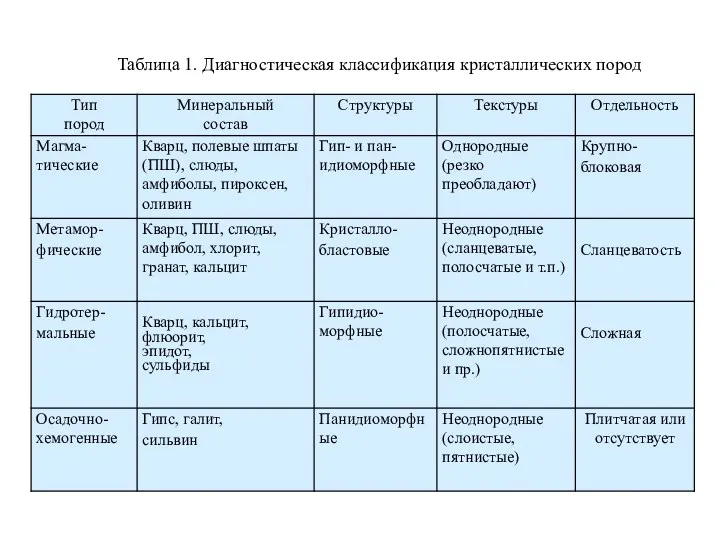 Диагностика метаморфических и гидротермальных горных пород
Диагностика метаморфических и гидротермальных горных пород Всероссийская олимпиада школьников по химии (региональный этап). Разбор заданий, 9 класс
Всероссийская олимпиада школьников по химии (региональный этап). Разбор заданий, 9 класс Готовимся к экзамену по химии
Готовимся к экзамену по химии Типы химических реакций. Реакции обмена
Типы химических реакций. Реакции обмена Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов
Обзор свойств неметаллов.. Окислительно-восстановительные свойства типичных неметаллов Основания. Состав, классификация, свойства, получение
Основания. Состав, классификация, свойства, получение Метод окислительно-восстановительного титрования
Метод окислительно-восстановительного титрования Обчислення за хімічними рівняннями відносного виходу продукту реакції
Обчислення за хімічними рівняннями відносного виходу продукту реакції Беймет алдар
Беймет алдар IVA группа С, Si, Ge, Sn, Pb (подгруппа титана)
IVA группа С, Si, Ge, Sn, Pb (подгруппа титана)