Содержание
- 2. Гидролиз солей «Три пути ведут к знанию: путь размышления – это путь самый благородный; путь подражания
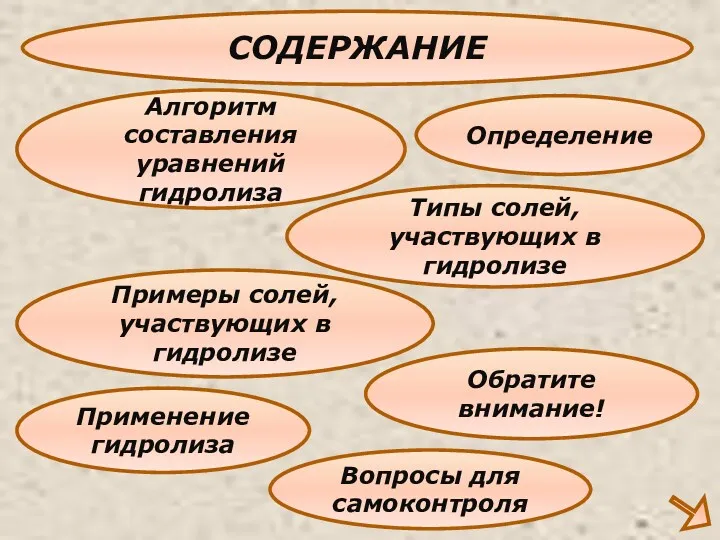
- 3. СОДЕРЖАНИЕ Определение Типы солей,участвующих в гидролизе Алгоритм составления уравнений гидролиза Применение гидролиза Примеры солей,участвующих в гидролизе
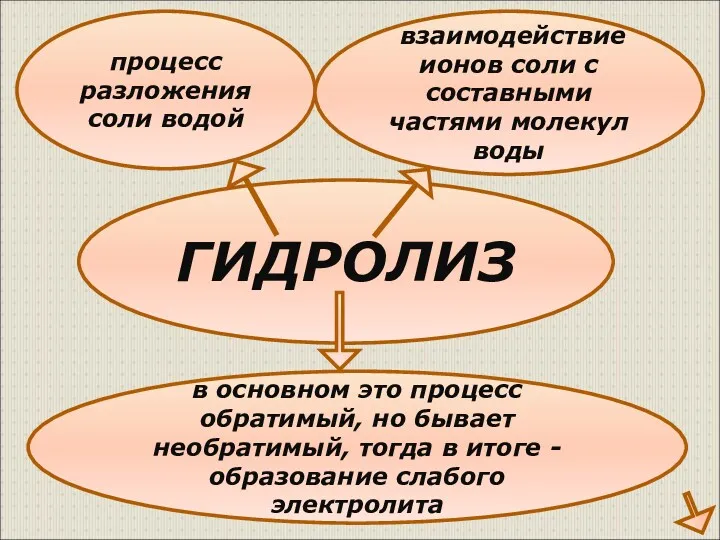
- 4. ГИДРОЛИЗ процесс разложения соли водой взаимодействие ионов соли с составными частями молекул воды в основном это
- 5. Новые понятия Гидролиз – реакция обмена между растворимыми солями и водой Сильные основания – сильные электролиты
- 6. Соль образована сильным основанием и сильной кислотой Соль образована сильным основанием и слабой кислотой Соль образована
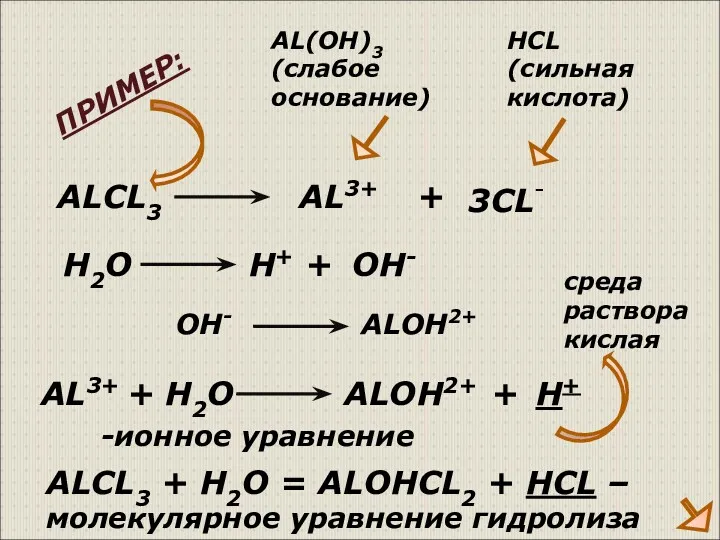
- 7. ALCL3 AL3+ + 3CL- AL(OH)3 (слабое основание) HCL (сильная кислота) AL3+ + H2O H+ OH- ALOH2+
- 8. О Б Р А Т И Т Е В Н И М А Н И Е:
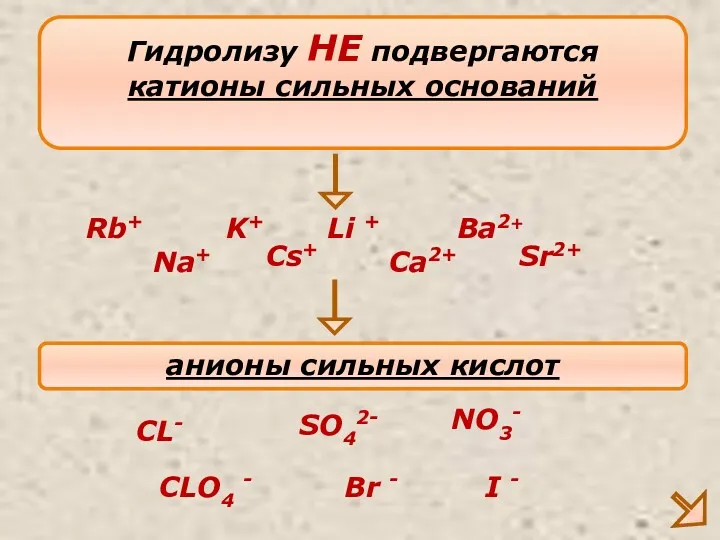
- 9. Гидролизу НЕ подвергаются катионы сильных оснований Na+ K+ Ca2+ анионы сильных кислот CL- SO42- NO3- Ba2+
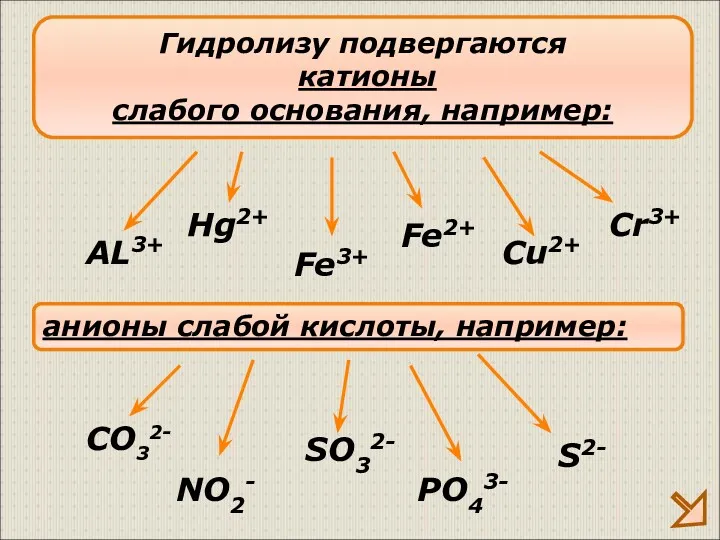
- 10. Гидролизу подвергаются катионы слабого основания, например: AL3+ Fe3+ Cu2+ анионы слабой кислоты, например: CO32- SO32- S2-
- 11. Классификация солей Задание1. Разделите предложенные формулы солей на четыре типа, объясните свой выбор: BaCl2, ZnSO4, CuCl2,
- 12. Алгоритм составления уравнений гидролиза Проверить растворимость соли. Определить состав соли, т.е. указать, каким по силе основанием
- 13. П Р И М Е Р Ы С О Л Е Й, П О Д В
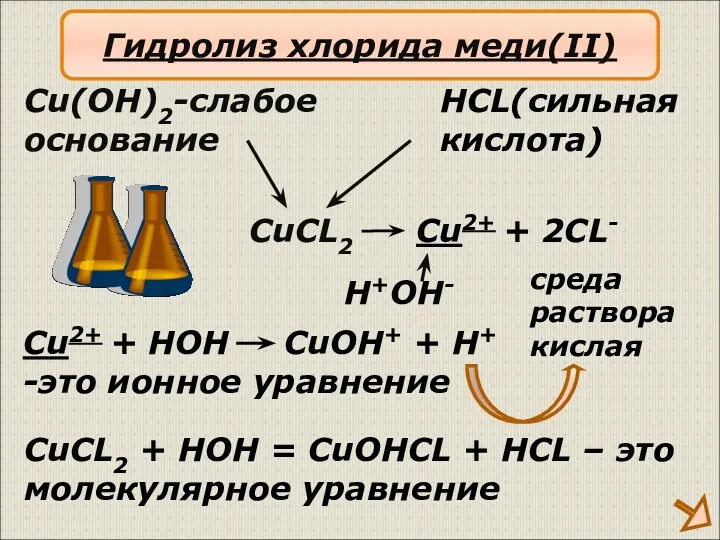
- 14. CuCL2 Cu(OH)2-слабое основание HCL(сильная кислота) Cu2+ + 2CL- H+OH- Cu2+ + HOH CuOH+ + H+ -это
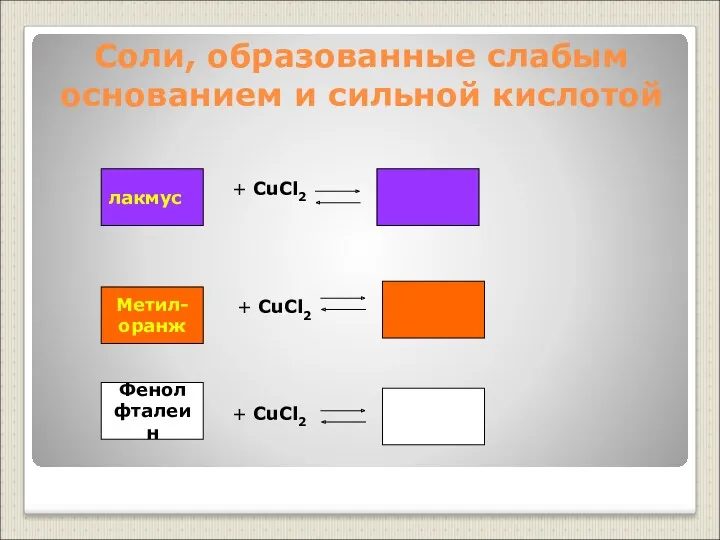
- 15. Соли, образованные слабым основанием и сильной кислотой Фенол фталеин + CuCl2 + CuCl2 + CuCl2 лакмус
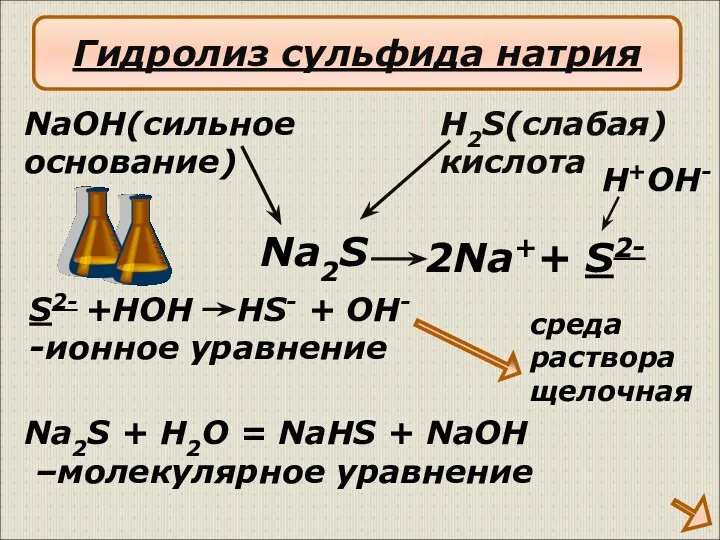
- 16. 2Na++ S2- NaOH(сильное основание) H2S(слабая) кислота S2- +HOH HS- + OH- -ионное уравнение Na2S + H2O
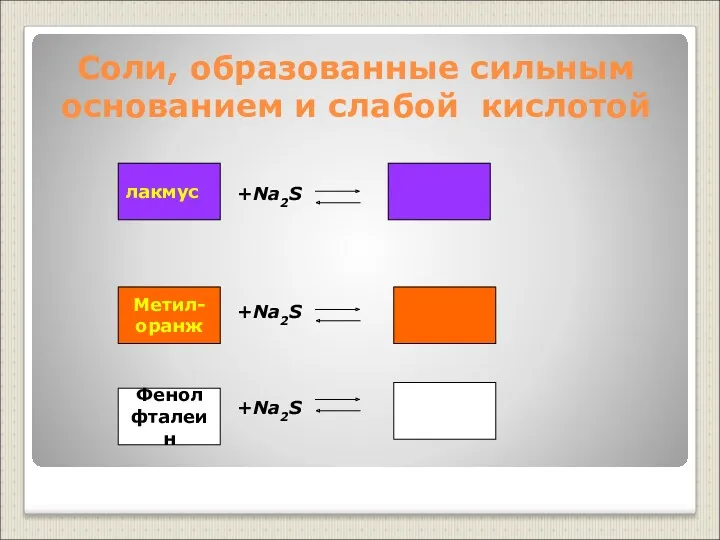
- 17. Соли, образованные сильным основанием и слабой кислотой +Na2S +Na2S +Na2S лакмус Метил- оранж Фенол фталеин
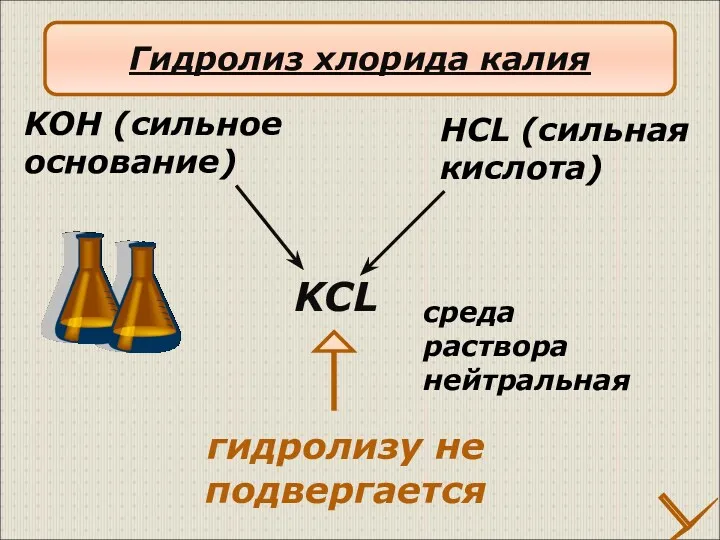
- 18. KCL HCL (сильная кислота) KOH (сильное основание) гидролизу не подвергается среда раствора нейтральная Гидролиз хлорида калия
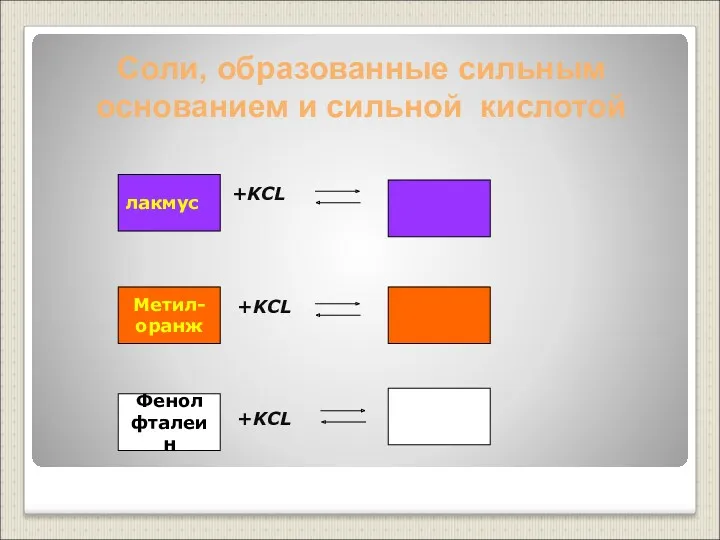
- 19. Соли, образованные сильным основанием и сильной кислотой +KCL +KCL +KCL лакмус Метил- оранж Фенол фталеин
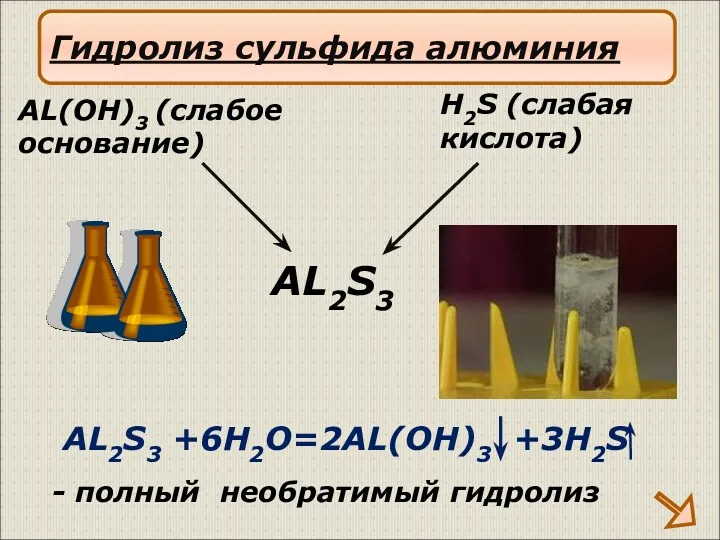
- 20. AL2S3 +6H2O=2AL(OH)3 +3H2S AL2S3 H2S (слабая кислота) AL(OH)3 (слабое основание) Гидролиз сульфида алюминия - полный необратимый
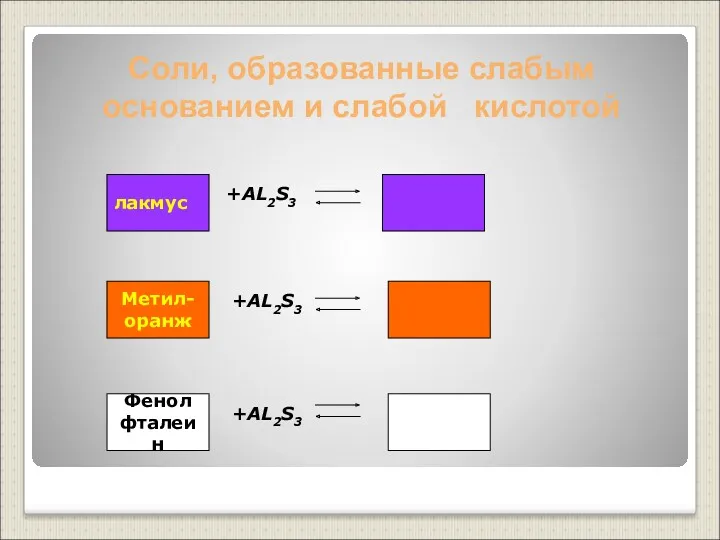
- 21. Соли, образованные слабым основанием и слабой кислотой +AL2S3 +AL2S3 +AL2S3 лакмус Метил- оранж Фенол фталеин
- 22. стирка мытье посуды умывание с мылом Роль гидролиза в повседневной жизни человека
- 23. Для умывания, стирки, мытья посуды нужны синтетические моющие средства, в основе которых содержатся в основном соли
- 24. А ТЕПЕРЬ ВОПРОСЫ….
- 25. Нейтральную среду имеет водный раствор: 1)нитрита натрия 2)силиката калия 3)хлорида железа (II) 4)нитрата калия Найди верный
- 26. В водном растворе какой соли фенолфталеин окрашен в малиновый цвет? 1)CaCl2 2)KNO3 3)FeSO4 4)Na2CO3 Найди верный
- 27. Одинаковую реакцию среды имеют растворы карбоната натрия и 1) нитрата натрия 2) силиката натрия 3) сульфата
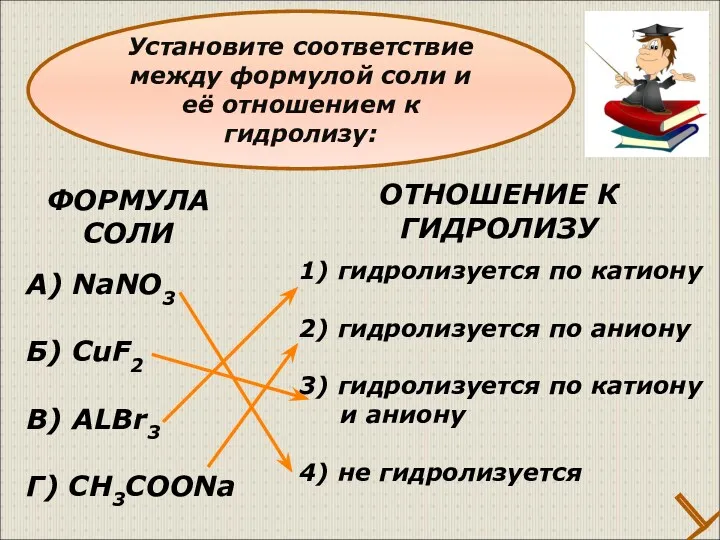
- 28. ФОРМУЛА СОЛИ А) NaNO3 Б) CuF2 В) ALBr3 Г) CH3COONa 1) гидролизуется по катиону 2) гидролизуется
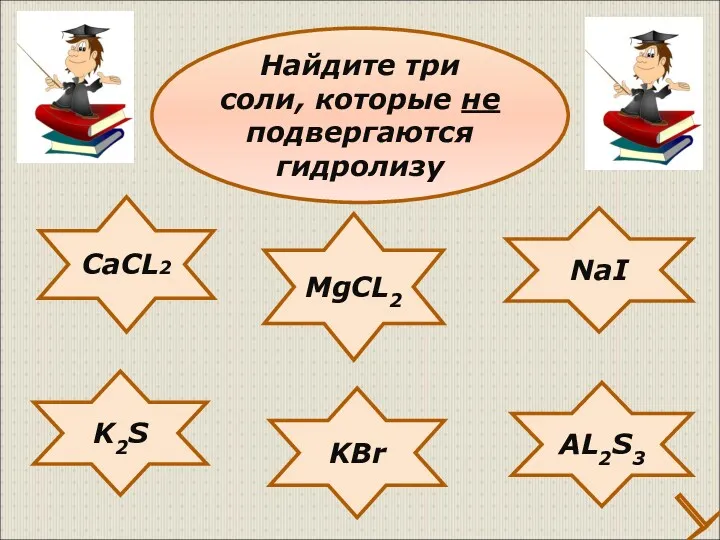
- 29. CaCL2 NaI K2S KBr AL2S3 MgCL2 Найдите три соли, которые не подвергаются гидролизу
- 30. Гидролиз нитрата алюминия идет по катиону Гидролиз сульфата бария идет по аниону Гидролиз щелочей не возможен
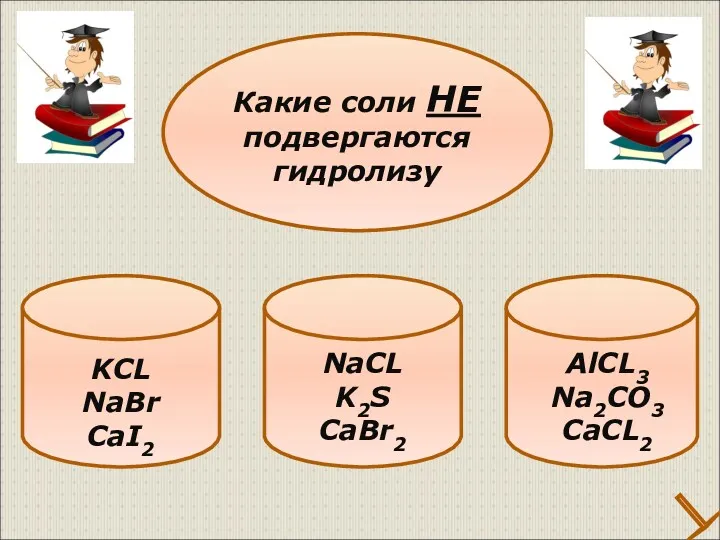
- 31. KCL NaBr CaI2 Какие соли НЕ подвергаются гидролизу NaCL K2S CaBr2 AlCL3 Na2CO3 CaCL2
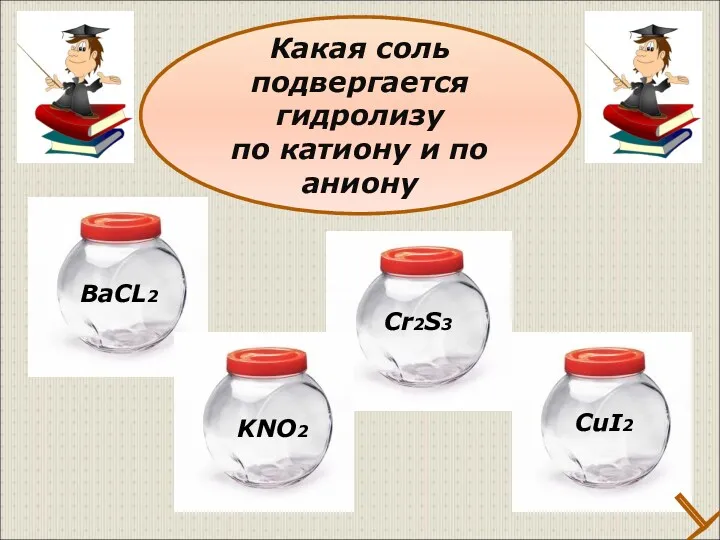
- 32. Какая соль подвергается гидролизу по катиону и по аниону ВаCL2 KNO2 Cr2S3 CuI2
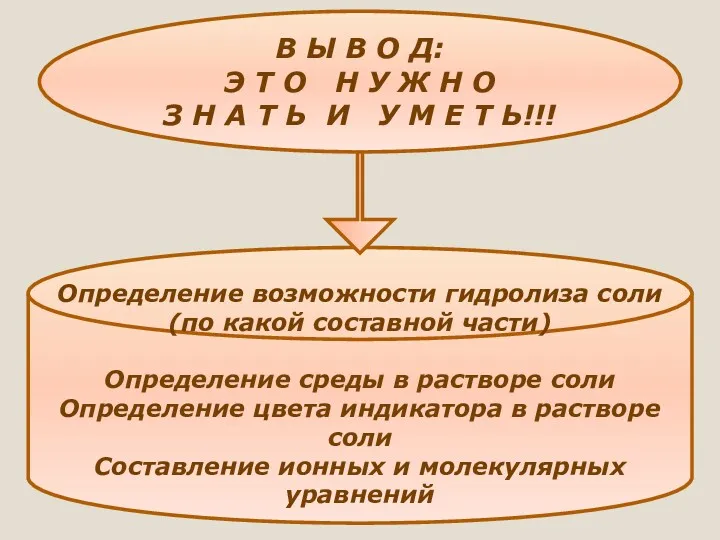
- 33. В Ы В О Д: Э Т О Н У Ж Н О З Н А
- 34. Домашнее задание § 1.12 Упр 7 стр 47
- 36. Скачать презентацию












 Лекция 5. Коллигативные свойства растворов
Лекция 5. Коллигативные свойства растворов становление органической химии
становление органической химии Полимерные материалы
Полимерные материалы Природные (натуральные) полимеры. Композиционные материалы
Природные (натуральные) полимеры. Композиционные материалы ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации
ВКР: Изучение золей на основе железа и марганца, полученных методом химической конденсации Возобновляемое сырье органической химии
Возобновляемое сырье органической химии Растворы и растворители
Растворы и растворители Поляризация электродов
Поляризация электродов Алкены (олефины). Лекция 3
Алкены (олефины). Лекция 3 Электроотрицательность химических элементов
Электроотрицательность химических элементов Алюминий и бор
Алюминий и бор Карбон қышқылдары
Карбон қышқылдары Атыраудағы химиялық өндіріс кәсіп орындары
Атыраудағы химиялық өндіріс кәсіп орындары Формальдегід. Будова та шкідливість
Формальдегід. Будова та шкідливість Изучение состава чая
Изучение состава чая Особенности строения твердых тел
Особенности строения твердых тел Галогенопохідні ароматичних вуглеводнів
Галогенопохідні ароматичних вуглеводнів Амины. Физические и химические свойства
Амины. Физические и химические свойства Массовая доля вещества в растворе. Урок химии. 8 класс
Массовая доля вещества в растворе. Урок химии. 8 класс Каучук. История открытия
Каучук. История открытия Types of chemical bonds in crystals
Types of chemical bonds in crystals Степень окисления. Подготовка к контрольной работе
Степень окисления. Подготовка к контрольной работе Химические свойства металлов
Химические свойства металлов Углеводы (сахариды)
Углеводы (сахариды) Изменения, происходящие с липидами в процессах технологической переработки сырья и параметры, характеризующие их
Изменения, происходящие с липидами в процессах технологической переработки сырья и параметры, характеризующие их Basis Sets and Pseudopotentials
Basis Sets and Pseudopotentials Ізомерія. Структурна ізомерія
Ізомерія. Структурна ізомерія Бор шикізатын қышқылдық ыдырату
Бор шикізатын қышқылдық ыдырату