При нагревании бор реагирует с другими галогенами с образованием тригалогенидов, с азотом образует нитрид бора BN, с фосфором —
фосфид BP, с углеродом — карбиды различного состава (B4C, B12C3, B13C2). При нагревании в атмосфере кислорода или на воздухе бор сгорает с большим выделением теплоты, образуется оксид B2O3:
С водородом бор напрямую не взаимодействует, хотя известно довольно большое число бороводородов (боранов) различного состава, получаемых при обработке боридов щелочных или щелочноземельных металлов кислотой:
При сильном нагревании бор проявляет восстановительные свойства. Он способен, например, восстановить кремний или фосфор из их оксидов:
Данное свойство бора можно объяснить очень высокой прочностью химических связей в оксиде бора B2O3.
При отсутствии окислителей бор устойчив к действию растворов щелочей. В горячей азотной, серной кислотах и в царской водке бор растворяется с образованием борной кислоты.
Оксид бора — типичный кислотный оксид. Он реагирует с водой с образованием борной кислоты:
При взаимодействии борной кислоты со щелочами возникают соли не самой борной кислоты — бораты (содержащие анион BO33−), а тетрабораты, например:


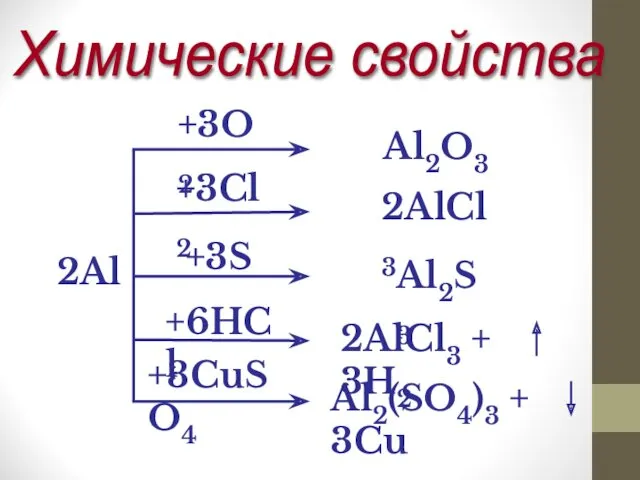













 Степень окисления
Степень окисления Радиохимия
Радиохимия Окисно-відновні реакції. 9 клас
Окисно-відновні реакції. 9 клас Жиры и масла
Жиры и масла Химическая связь
Химическая связь 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Электролитическая диссоциация. Занятие 14
Электролитическая диссоциация. Занятие 14 Кремний и его соединения
Кремний и его соединения Перегонка с водяным паром
Перегонка с водяным паром Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Analytical chemistry methods
Analytical chemistry methods Строение и переваривание липидов. Классификация и роль жирных кислот. Нутриомика. Липофильных соединений
Строение и переваривание липидов. Классификация и роль жирных кислот. Нутриомика. Липофильных соединений Периодическая система химических элементов Д.И.Менделеева
Периодическая система химических элементов Д.И.Менделеева Катализ металлами. Лекция 3
Катализ металлами. Лекция 3 Алкины. Ацетилен.
Алкины. Ацетилен. Көмірсулар Қайталау сабағы
Көмірсулар Қайталау сабағы Предельные углеводороды
Предельные углеводороды Агрегатные состояния вещества
Агрегатные состояния вещества Типы химических реакций в органической химии
Типы химических реакций в органической химии Приложения II начала термодинамики
Приложения II начала термодинамики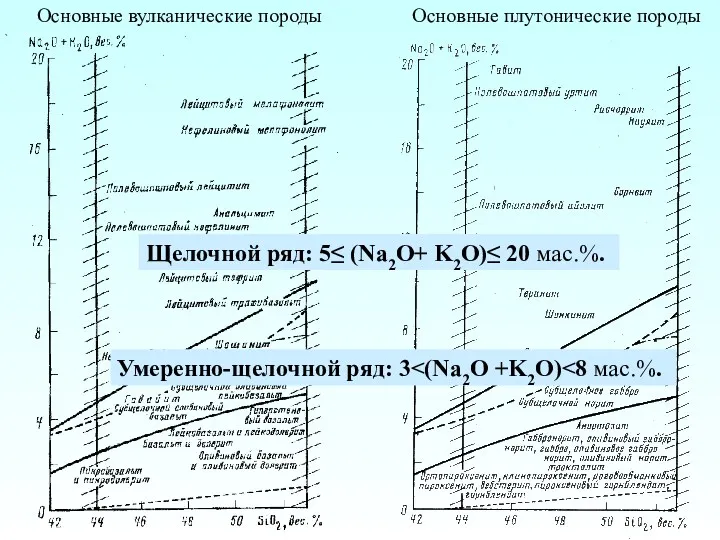 Основные вулканические породы. Основные плутонические породы
Основные вулканические породы. Основные плутонические породы ЕГЭ по химии. Анализ результатов решения (часть 2)
ЕГЭ по химии. Анализ результатов решения (часть 2) Нұсқа талдау
Нұсқа талдау Техника безопасности в химической лаборатории и на уроках химии
Техника безопасности в химической лаборатории и на уроках химии Углеводороды (классификация и номенклатура)
Углеводороды (классификация и номенклатура) Золото Au (Аурум)
Золото Au (Аурум) Природные источники углеводородов
Природные источники углеводородов Периодический закон и периодическая система химических элементов Д.И. Менделеева
Периодический закон и периодическая система химических элементов Д.И. Менделеева