Содержание
- 2. Содержание Модуль 1. Электролиты и неэлектролиты Модуль 2. Теория электролитической диссоциации Модуль 3. Степень электролитической диссоциации
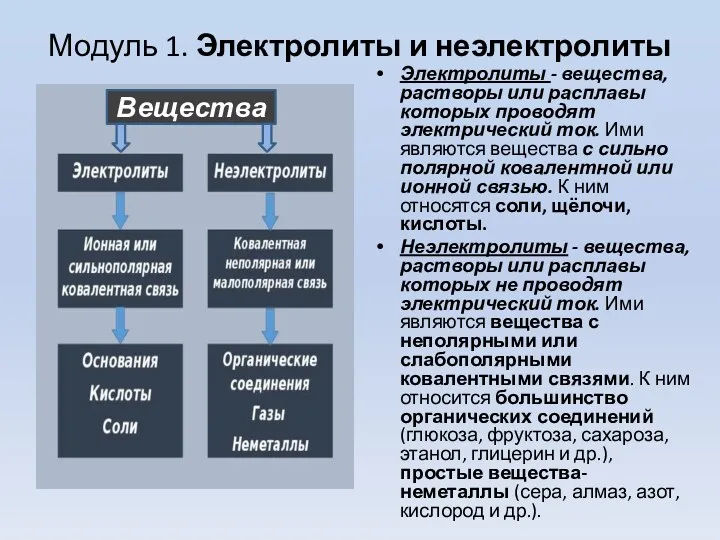
- 3. Модуль 1. Электролиты и неэлектролиты Электролиты - вещества, растворы или расплавы которых проводят электрический ток. Ими
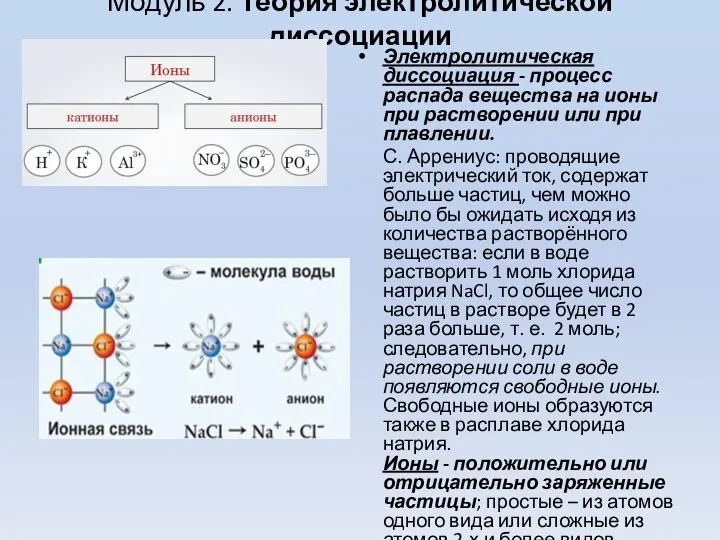
- 4. Модуль 2. Теория электролитической диссоциации Электролитическая диссоциация - процесс распада вещества на ионы при растворении или
- 5. Для объяснения свойств водных растворов электролитов С. Аррениус в году предложил теорию электролитической диссоциации (ТЭД). Эта
- 6. ПОЛОЖЕНИЯ ТЕОРИИ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ При растворении в воде электролиты диссоциируют (распадаются) на ионы. Свойства ионов отличаются
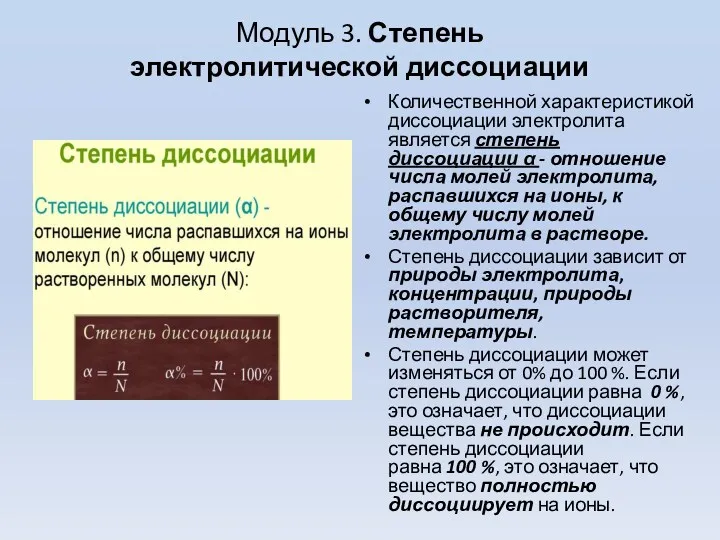
- 7. Модуль 3. Степень электролитической диссоциации Количественной характеристикой диссоциации электролита является степень диссоциации α - отношение числа
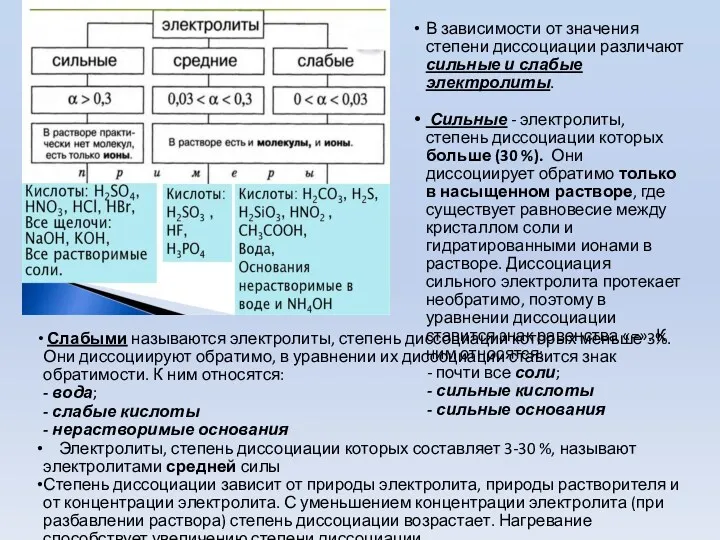
- 8. В зависимости от значения степени диссоциации различают сильные и слабые электролиты. Сильные - электролиты, степень диссоциации
- 9. Модуль 4. Кислоты, основания и соли с точки зрения теории электролитической диссоциации Кислоты - электролиты, при
- 10. Основания - электролиты, при диссоциации которых образуются катионы металла и гидроксид-ионы Характерные общие свойства оснований обусловлены
- 11. Амфотерные гидроксиды - электролиты, которые способны диссоциировать по типу кислоты и по типу основания Амфотерные гидроксиды
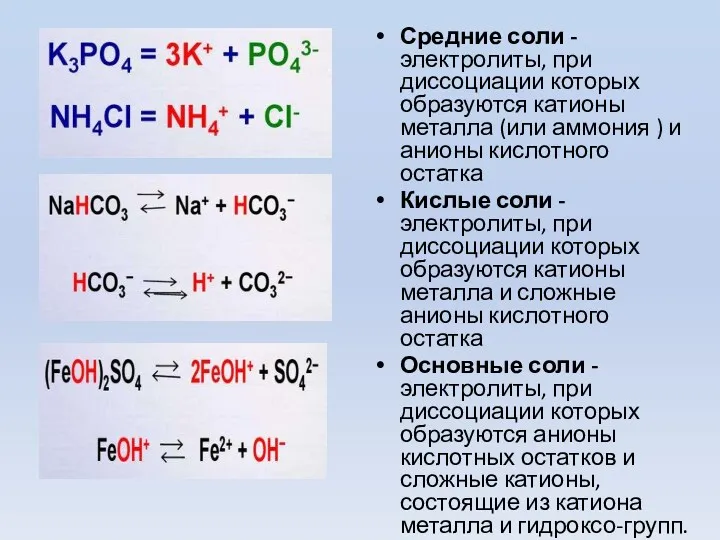
- 12. Средние соли - электролиты, при диссоциации которых образуются катионы металла (или аммония ) и анионы кислотного
- 14. Скачать презентацию






 Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу
Біріншілік алкилсульфаттар және алкилэтоксисульфаттарды алу Синтетические топлива
Синтетические топлива Определение витамина “С” в продуктах питания с помощью иодометрии
Определение витамина “С” в продуктах питания с помощью иодометрии Геолого-промышленные типы месторождений полезных ископаемых
Геолого-промышленные типы месторождений полезных ископаемых Актиноиды. Физические и химические свойства
Актиноиды. Физические и химические свойства Этапы гравиметрического анализа. (Лекция 3)
Этапы гравиметрического анализа. (Лекция 3) Искусственная и синтетическая резина
Искусственная и синтетическая резина Элементный, фракционный и химический состав нефти. Классификация нефтей
Элементный, фракционный и химический состав нефти. Классификация нефтей Алкины. Ацетиленовые углеводороды
Алкины. Ацетиленовые углеводороды Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Подготовка к ГИА. А2. Периодический закон и Периодическая система химических элементов Д.И. Менделеева Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах
Физико-химические методы в анализе ЛВ. Метод ионометрии в анализе ЛВ. Определение спирта в фармацевтических препаратах Галогены (солеобразующие)
Галогены (солеобразующие) Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері
Суды коагуляциялау әдісі. Судың сапасын жақсартудың арнайы әдістері Чистые вещества и смеси. Химия. 8 кл
Чистые вещества и смеси. Химия. 8 кл Свойства воды. Оценка качества
Свойства воды. Оценка качества Теплота сгорания топлива
Теплота сгорания топлива Железо и его соединения
Железо и его соединения Коррозия металлов
Коррозия металлов Классы неорганических веществ. Соли
Классы неорганических веществ. Соли Растворы. Способы выражения концентрации растворенного вещества
Растворы. Способы выражения концентрации растворенного вещества Анионы. Группы анионов
Анионы. Группы анионов Электронное строение атома
Электронное строение атома Metal–metal multiple bonded intermediates in catalysis
Metal–metal multiple bonded intermediates in catalysis Магний (Mg)
Магний (Mg) Химические свойства солей в свете теории электролитической диссоциации
Химические свойства солей в свете теории электролитической диссоциации Удивительный мир камня
Удивительный мир камня Щелочные металлы
Щелочные металлы Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)
Характеристики химического процесса. Степень превращения, селективность, выход продукта. (Лекция 1.2)