Содержание
- 2. F 1S22S22P5 S P CI 1S22S22P63S23P5 Br I …4S24P5 …5S25P5 Электронные формулы Вывод: галогены - р
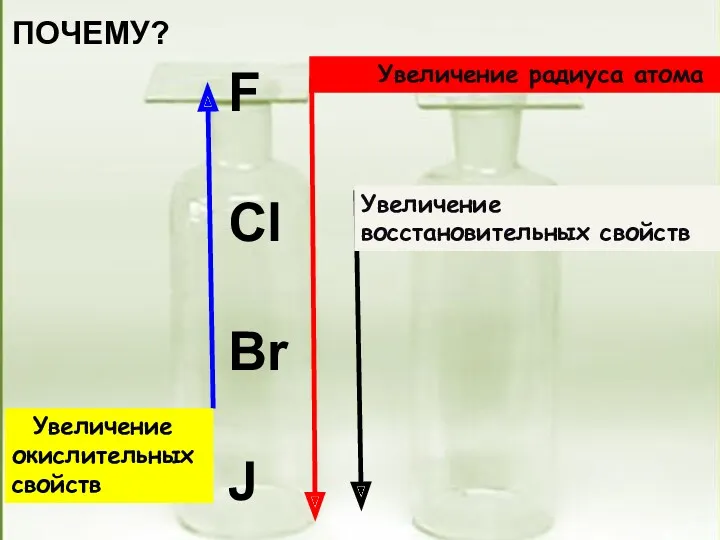
- 3. Увеличение окислительных свойств F Cl Br J ПОЧЕМУ? Увеличение радиуса атома Увеличение восстановительных свойств
- 4. CI2 Br2 I2 F2 Простые вещества
- 5. Химическая связь К Н Кристаллическая решетка молекулярная
- 7. Хлор
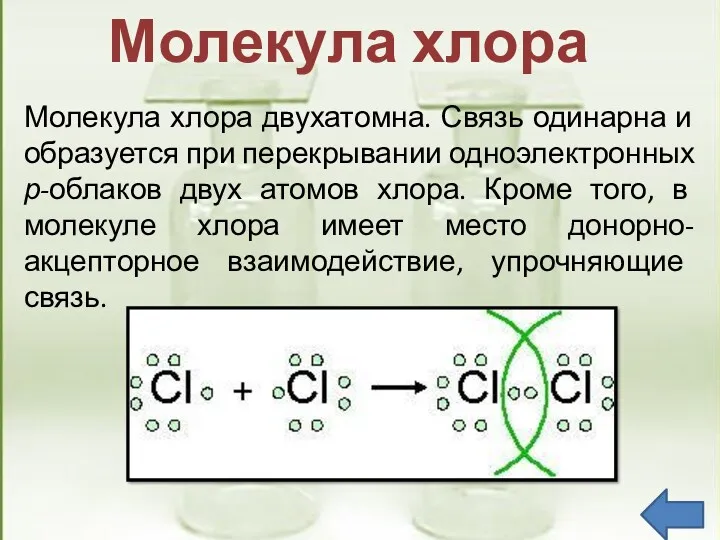
- 10. Молекула хлора двухатомна. Связь одинарна и образуется при перекрывании одноэлектронных р-облаков двух атомов хлора. Кроме того,
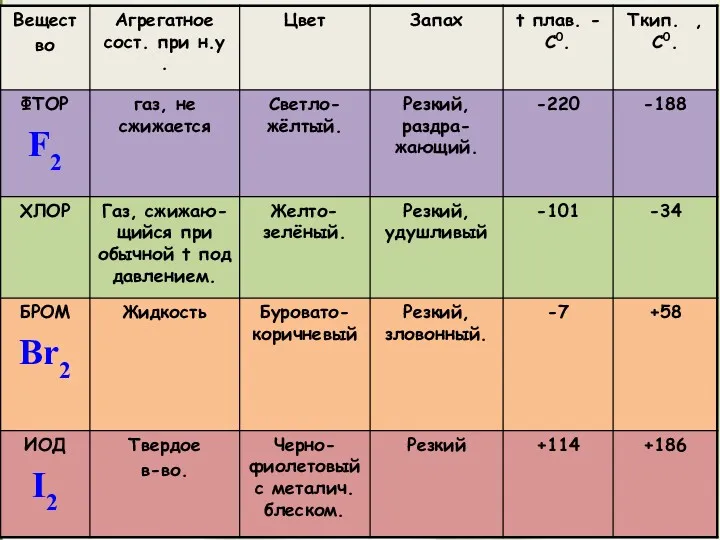
- 11. Физические свойства
- 12. Минералы Каменная соль = поваренная соль = галит Карналлит Сильвин
- 13. Получение Электролиз хлоридов щелочных металлов (NaCl, KCl). Окисление HCl кислородом воздуха 4HCl + O2 = 2Cl2
- 14. Получение 2KMnO4+16HCl (конц.)= 2KCl + 2MnCl2 + 8H2O + 5Cl2
- 15. Химические свойства Хлор – активный окислитель. Энергично реагирует с металлами и большинством неметаллов (за исключением O2,
- 16. Хлор - один из самых активных неметаллов. При взаимодействии с металлами с переменной валентностью (Fe, Cr)
- 17. Cu+Cl2=CuCl2 2Fe+3Cl2 = 2FeCl3
- 18. H2 + Cl2 = 2 HCl(на свету) С Неметаллами 2Cl2 + C = CCl4 3Cl2 +
- 19. Образует соединения с другими галогенами: Cl2 + F2 = 2ClF Cl2 + 3F2 = 2ClF3, t
- 20. Хлор растворяется вводе (в 1 объеме воды растворяется 2 объема хлора) с образованием "хлорной воды": Cl2
- 21. С Бескислородными Кислотами Cl2 + HBr = 2HCl + Br2 Cl2 + HI = 2HCl +
- 22. Хлор в органике Хлор является активным реагентом в органическом синтезе. Его атомы входят в состав молекул
- 23. Для обеззараживания воды — «хлорирования». В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов,
- 24. Производство хлорорганических инсектицидов — веществ, убивающих вредных для посевов насекомых, но безопасных для растений. На получение
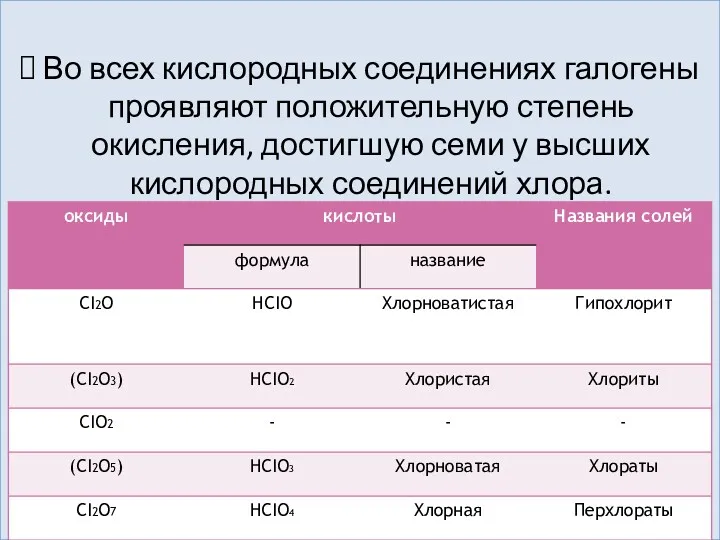
- 25. Во всех кислородных соединениях галогены проявляют положительную степень окисления, достигшую семи у высших кислородных соединений хлора.
- 26. Хлорноватистая кислота Получение: CI2 + H2O ↔ HCIO + HCI. Свойства : очень неустойчива : 2HCIO
- 27. - Смесь солей хлорноватистой и соляной кислот называется жавелевой водой и применяется для отбеливания: 2KOH +
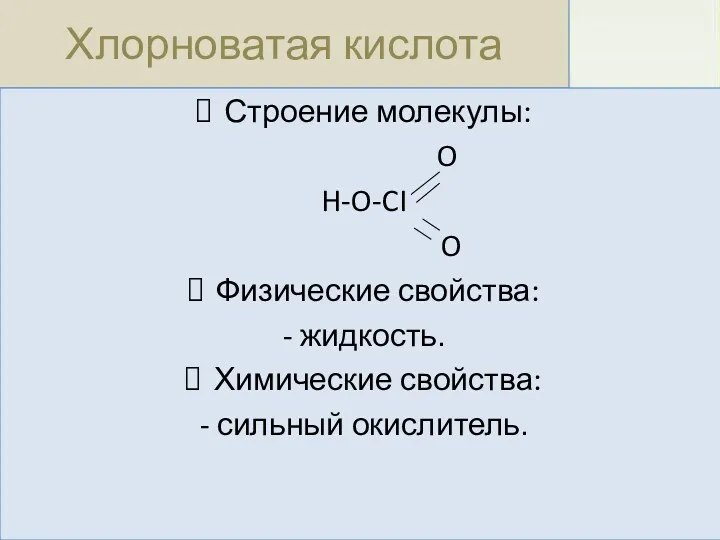
- 28. Хлорноватая кислота Строение молекулы: O H-O-CI O Физические свойства: - жидкость. Химические свойства: - сильный окислитель.
- 29. Получение хлората калия: 3KCIO = KCIO3 + 2KCI (при нагревании) 6KOH +3CI2 = 5KCI + KCIO3
- 30. Хлорная кислота Строение молекулы O H-O- CI=O O Физические свойства: -жидкость, - без цвета, - замерзает
- 31. Выводы С увеличением валентности хлора растёт устойчивость его кислородных кислот, а их окислительная способность уменьшается: HCIO
- 32. Соединения хлора физические свойства хлороводорода - газ; - без цвета; - с резким запахом; - легко
- 33. Получение хлороводорода В промышленности: действие концентрированной серной кислоты на соли галогеноводородных кислот 2NaCI + H2SO4 =
- 34. Получение: - растворением хлороводорода в воде; - синтез путём сжигания водорода в струе хлора H2 +
- 36. Скачать презентацию




























 Карбоновые кислоты. 10 класс
Карбоновые кислоты. 10 класс Взаимодействие кислоты с основанием (реакция нейтрализации)
Взаимодействие кислоты с основанием (реакция нейтрализации)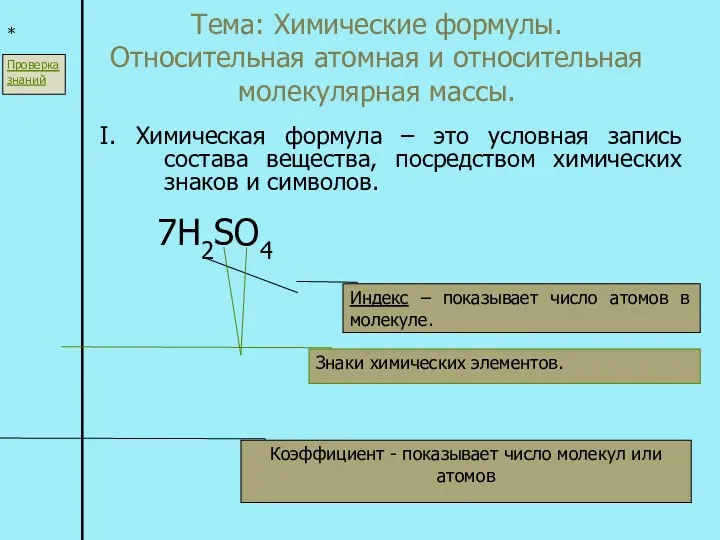 Химические формулы. Относительная атомная и относительная молекулярная массы
Химические формулы. Относительная атомная и относительная молекулярная массы Автомобильные пластичные смазки
Автомобильные пластичные смазки Кристаллы. Кристаллические вещества
Кристаллы. Кристаллические вещества Периодическая система химических элементов Д.И. Менделеева. Строение атома
Периодическая система химических элементов Д.И. Менделеева. Строение атома Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар
Витаминдер. Витаминдердің классификациясы. Алиментарлы және екіншілік авитаминоздар. Гипервитаминоздар Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа
Приготовление растворов с определенной массовой долей растворенного вещества. Практическая работа Полимеры органические и неорганические
Полимеры органические и неорганические Лабораторна робота. Властивості амінів
Лабораторна робота. Властивості амінів Электролиз
Электролиз Роль химии в современной цивилизации
Роль химии в современной цивилизации Углеводородное сырье: способы переработки
Углеводородное сырье: способы переработки Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы
Карбон қышқылдары, жіктелуі, сипаттамалары, таралуы Осмий. Нахождение в природе
Осмий. Нахождение в природе Альдегиды и кетоны
Альдегиды и кетоны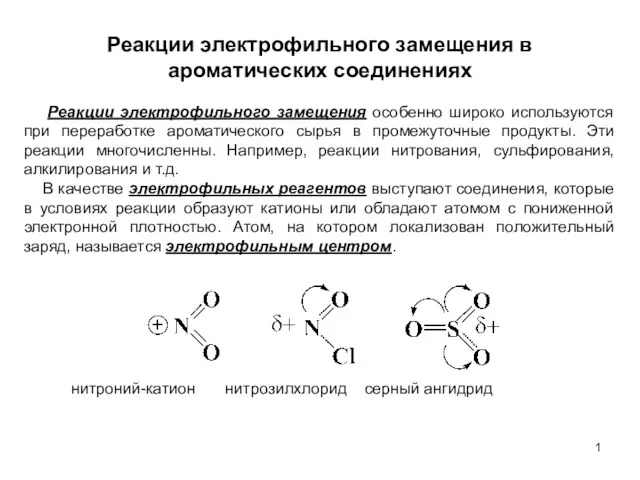 Реакции электрофильного замещения в ароматических соединениях. (Лекция 6)
Реакции электрофильного замещения в ароматических соединениях. (Лекция 6) Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты
Триглицериды. Липиды. Средства ухода за кожей. Лекция 3. Индустрия красоты Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар
Ауыл шаруашылығындағы минералды. Тыңайтқыш-азық-түліктегі нитраттар Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння
Тепловий ефект хімічних реакцій. Екзотермічні ї ендотермічні реакції термохімічні рівняння Осадочные и метаморфические горные породы
Осадочные и метаморфические горные породы Объемная доля компонента газовой смеси
Объемная доля компонента газовой смеси Органічна хімія
Органічна хімія Первичная переработка нефти
Первичная переработка нефти Nuclear Energy, Controlled Fission and Fusion 2016
Nuclear Energy, Controlled Fission and Fusion 2016 Гидроксикислоты (оксикислоты)
Гидроксикислоты (оксикислоты) Лекция 3. Протолитические равновесия и процессы
Лекция 3. Протолитические равновесия и процессы Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования
Карбоновые кислоты и их функциональные производные. Хроматографические методы исследования