Содержание
- 2. В точке эквивалентности число эквивалентов вещества А = числу эквивалентов вещества В - основное уравнение объемного
- 3. Вычисления в титриметрическом анализе Концентрация растворов, способы выражения. Концентрация раствора – это весовое количество данного вещества,
- 4. Форма записи: 0,1 М H2SO4 или С(H2SO4) = 1 моль/дм Нормальная концентрация – показывает число молей
- 5. Фактор эквивалентности рассчитывают по реакции: Титр – количество граммов вещества в 1 см3 (миллилитре) раствора ,
- 6. Приготовление титрованных растворов Отметим следующие основные способы приготовления титрованных растворов: 1) из фиксаналов – на заводе
- 7. Установочные вещества отвечают следующим требованиям: 1) имеют кристаллическую структуру и определенную химическую форму; 2) их химический
- 8. Способы и методы титрования Различают два основных метода: метод пипетирования и метод отдельных навесок, и три
- 9. 2) Обратное титрование (титрование по избытку или титрование по остатку) Схема титрования: отсюда или 3) Титрование
- 10. но тогда и или В любом титровании мы преследуем основную цель – определение точки эквивалентности. Точка
- 11. Графический метод изображения процесса нейтрализации Графическим выражением процесса кислотно-основного титрования (нейтрализации) являются кривые титрования, построенные в
- 12. 1) X=0 В колбе для титрования раствор сильной кислоты. где - исходная концентрация кислоты. 2) 0
- 13. 4) X>1 В колбе появляется свободная щелочь. где - концентрация добавленной щелочи. Кривые титрования дают возможность
- 14. Следовательно, мы имеем право закончить титрование в интервале X=0,999÷1,001 (± 0,1% от 1 ), когда происходит
- 15. Титрование слабой кислоты сильным основанием Схема титрования Кривая титрования и расчет имеют особенности. 1) X=0 Расчет
- 16. 4) X > 1 – в реакционной системе появляется избыток щелочи. Выводы: 1) Кривая титрования слабой
- 17. Рассмотрим титрование 0,1М HAn с рK=5. Область скачка ΔрН±0,1%=8÷10. Выбор индикатора: фенолфталеин ΔрН=8÷10 метилоранж ΔрН=3÷5 Пригоден
- 18. 3) X=1 В колбе для титрования соль, но она подвергается гидролизу рН 4) X > 1
- 20. Скачать презентацию

















 Химические свойства алкенов
Химические свойства алкенов Хімічний склад і використання мінералів
Хімічний склад і використання мінералів Получение уксусной кислоты и опыты с ней
Получение уксусной кислоты и опыты с ней Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса
Термокаталитические процессы. Каталитический крекинг. Классификация и основные факторы процесса Классификация органических соединений
Классификация органических соединений Классы неорганических соединений. 8 класс
Классы неорганических соединений. 8 класс Знаки вторичной переработки
Знаки вторичной переработки Застосуванння електролiзу
Застосуванння електролiзу Магматические формации
Магматические формации Человек в мире веществ, материалов и химических реакций. Химия и пища
Человек в мире веществ, материалов и химических реакций. Химия и пища Химическая связь в кластерах
Химическая связь в кластерах Окислительно-восстановительные реакции в органической химии
Окислительно-восстановительные реакции в органической химии Общая характеристика элементов V группы главной подгруппы
Общая характеристика элементов V группы главной подгруппы Ароматические углеводороды. Арены
Ароматические углеводороды. Арены Катализ. Классификация каталитических процессов. Механизм действия катализаторов
Катализ. Классификация каталитических процессов. Механизм действия катализаторов Структура стекла
Структура стекла Свойства кислот и оснований в свете теории электролитической диссоциации
Свойства кислот и оснований в свете теории электролитической диссоциации Фосфор и его основные соединения
Фосфор и его основные соединения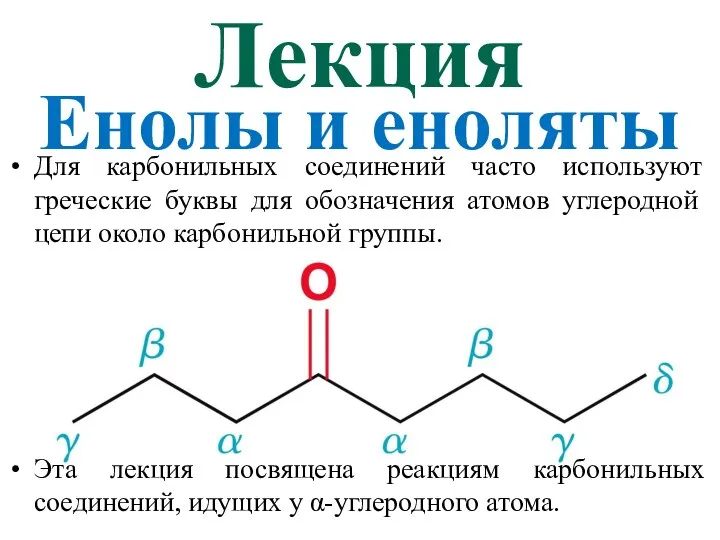 Енолы и еноляты
Енолы и еноляты Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки
Ступінь окиснення. Визначення ступеня окиснення елемента за хімічною формулою сполуки Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия
Химические процессы в атмосфере. Загрязнение атмосферы. Причины и последствия Белки. 9 класс
Белки. 9 класс Коррозия и защита строительных материалов
Коррозия и защита строительных материалов ЕГЭ Химия. Задание №5
ЕГЭ Химия. Задание №5 Сопряжение. Ароматичность. Электронные эффекты заместителей
Сопряжение. Ароматичность. Электронные эффекты заместителей Химическая связь. Взаимное влияние атомов в молекуле
Химическая связь. Взаимное влияние атомов в молекуле Ізомери у природі
Ізомери у природі Полимеры. Пластмассы. Волокна
Полимеры. Пластмассы. Волокна