Содержание
- 2. Катализ В общем случае катализ это ускорение реакции под действием особых химических соединений – катализаторов. Катализатор
- 3. Катализаторы Если катализатор не выходит в неизмен-ном виде, а расходуется в побочных реакциях, то такие стадии
- 4. Классификация каталитических процессов По фазовому составу каталитические реакции делятся: Гомогенный катализ (Исходные вещества и катализатор находятся
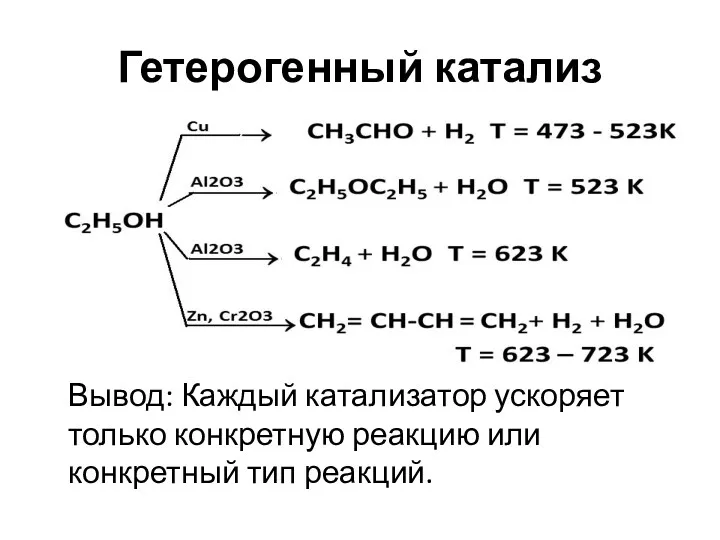
- 5. Гетерогенный катализ Вывод: Каждый катализатор ускоряет только конкретную реакцию или конкретный тип реакций.
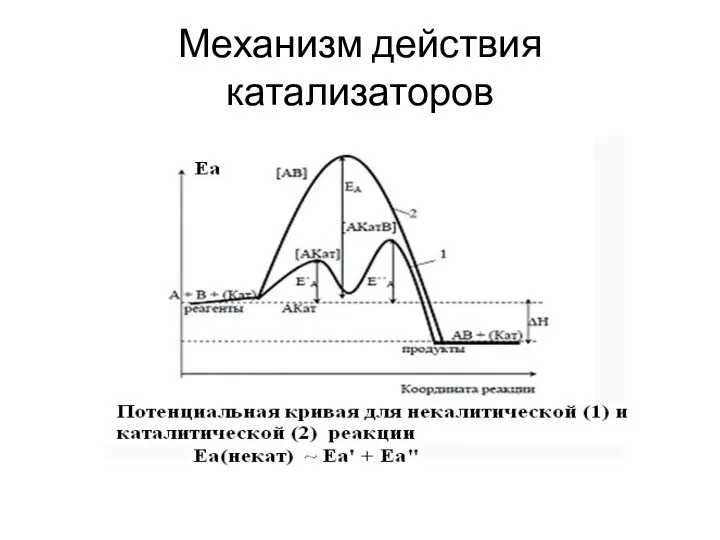
- 6. Механизм действия катализаторов
- 7. Эффективность катализатора В гомогенном катализе мерой активности является число оборотов реакции nk (TOF), т.е. количество молекул,
- 8. Эффективность катализатора Интегральная избирательность или селективность – отношение количества целевого продукта к теоретически возможному из взятого
- 9. Виды гомогенного катализа Кислотно – основной (Катализатор – кислота или основание) Металло –комплексный ( катализатор –
- 10. Кислотно – основной гомогенный катализ
- 11. Кислотно – основной катализ По C.Аррениусу (1884 г) кислота – это соединение, образующее при диссоциации в
- 12. Кислотно – основной катализ По Дж.Брестеду и Т.Лоури (1923 г) кислота – это вещество, являющее донором
- 13. Кислотно – основной катализ По Г.Льюису кислота – это акцептор неподеленной пары электронов, а основание вещество,
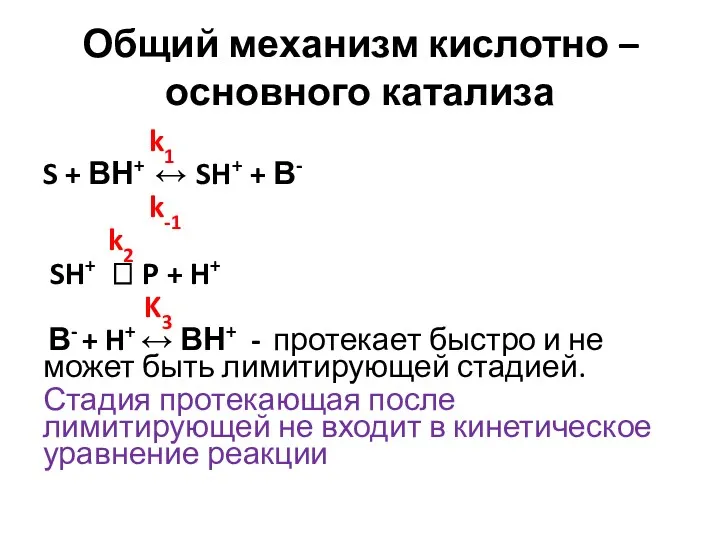
- 14. Общий механизм кислотно – основного катализа k1 S + ВН+ ↔ SH+ + В- k-1 k2
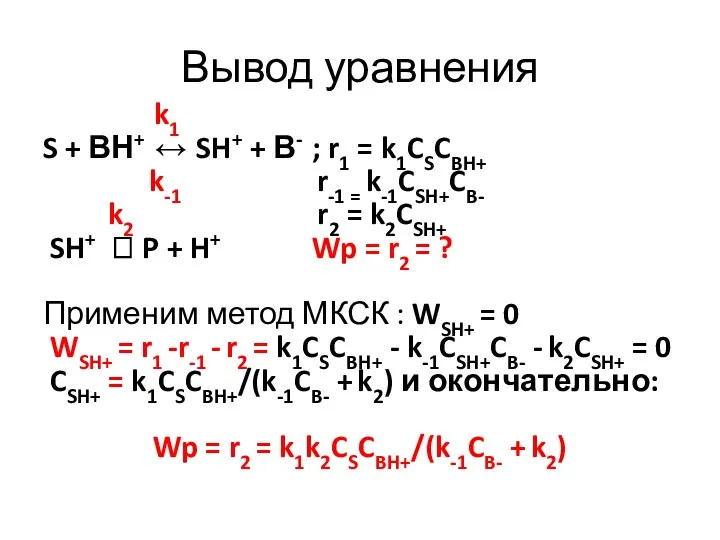
- 15. Вывод уравнения k1 S + ВН+ ↔ SH+ + В- ; r1 = k1CSCBH+ k-1 r-1
- 16. Анализ уравнения Wp = k1k2CSCBH+/(k-1CB- + k2) 1. Предположим, что k-1CB- Wp = k1k2CSCBH+/ k2 =
- 17. Итоги по общему кислотно – основному катализу Общий кислотный катализ . В этом случае катализатором являются
- 18. Кислотно – основной катализ По Дж.Брестеду и Т.Лоури (1923 г) кислота – это вещество, являющее донором
- 19. Общий (Неспецифический) кислотный катализ Wp = k1CSCBH+= kнаблCS ; kнабл = Wp/CS ; kнабл = k’1CB’H+
- 20. Вернемся к общей схеме k1 S + ВН+ ↔ SH+ + В- k-1 k2 SH+ ?
- 21. 2. При условии k-1CB- >> k2 и получим: Wp = k1k2CSCBH+/k-1CB- = k2(k1/k-1)*CSCBH+/CB- Wp = k2K1*CSCBH+/CB-
- 22. K3 = аBH+ /аB-aH+ = CBH+/CB- aH+ *(γB-/γBH+ ) Обратите внимание, что мы оставили aH+ Отсюда
- 23. Реакции специфического кислотно – основного катализа Специфический кислотный катализ. В этом случае катализатором являются кислоты Аррениуса,
- 24. Специфический кислотный катализ в разбавленных растворах Wp = k2K1K3CSaH+*γB- /γBH+ В разбавленных растворах γB- /γBH+ =
- 25. Кислотно – основной катализ По C.Аррениусу (1884 г) кислота – это соединение, образующее при диссоциации в
- 26. Специфический кислотный катализ в концентрированных растворах Wp = k2K1Ka3CSaH+*γB- /γBH+ =kнаблCS(aH+γB- /γBH+) Гаммет ввел новую функцию
- 28. Реакции электрофильно – нуклеофильного катализа Электрофильный катализ. В этом случае катализаторами являются кислоты Льюиса и механизм
- 29. Реакции электрофильно – нуклеофильного катализа Нуклеофильный катализ. В этом случае катализаторами являются основания Льюиса: амины,R3N, R2HN,
- 30. Суперкислоты Термин суперкислота введён Джеймсом Конантом в 1927 году для классификации более сильных кислот, чем обычные
- 31. Cуперкислоты Магическая кислота получила своё название за исключительную способность растворять воск. Она является смесью пентафторида сурьмы,
- 32. Протонные суперкислоты К простым суперкислотам относят трифторметансульфоновую (CF3SO3H), хлорную , хлорсульфоновую, пентафторэтансульфоновую, фторсульфоновую (FSO3H) кислоты. Во
- 33. Карборановая кислота Карборановая кислота — самая сильная кислота (суперкислота) из допускающих возможность хранения в специальных сосудах.
- 35. МЕТАЛЛОКOМПЛЕКСНЫЙ КАТАЛИЗ Основан на взаимодействии субстрата с реагентом в координационной сфере комплекса металла. Металлокомплексный катализ может
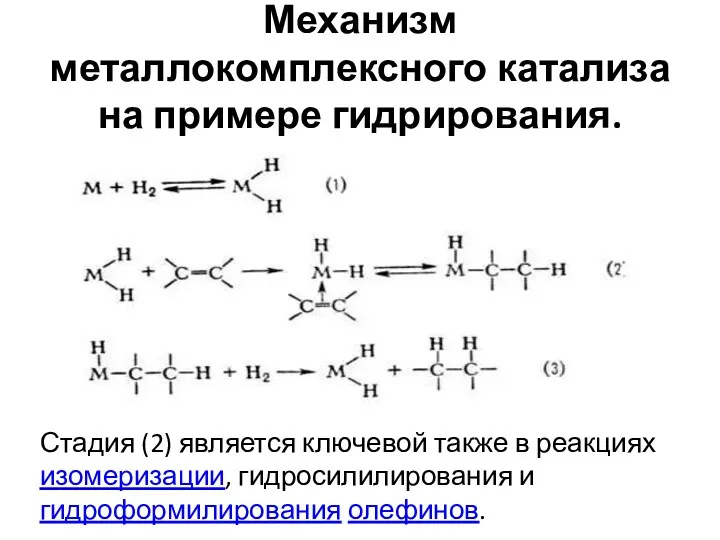
- 36. Механизм металлокомплексного катализа на примере гидрирования. Стадия (2) является ключевой также в реакциях изомеризации, гидросилилирования и
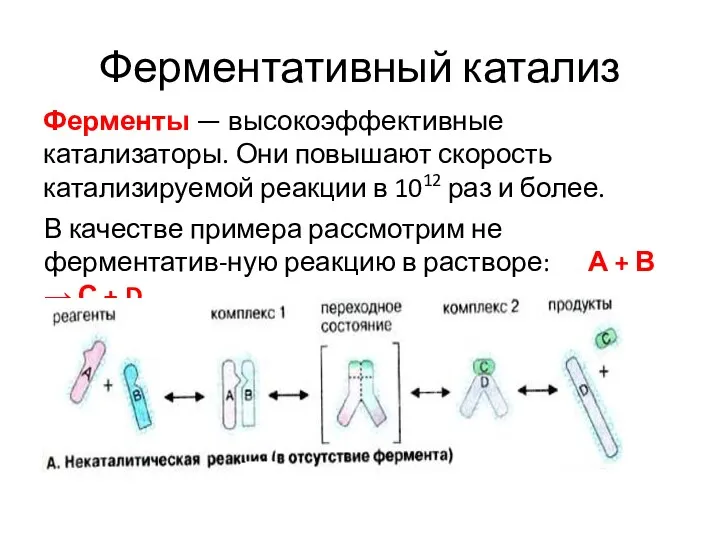
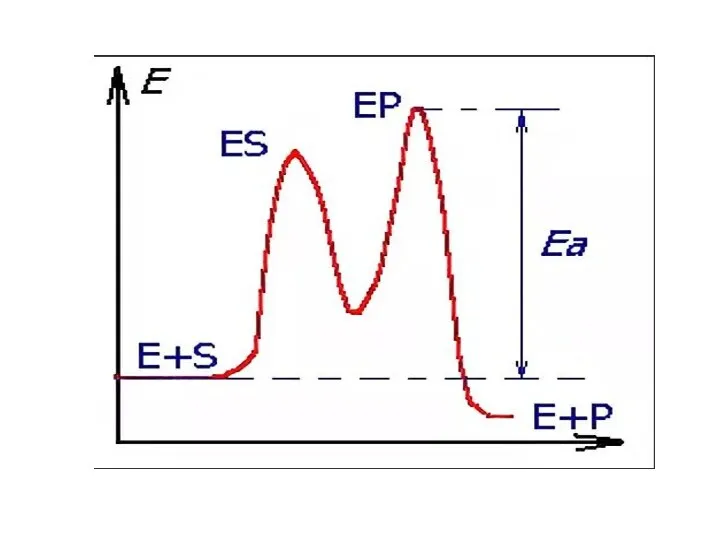
- 37. Ферментативный катализ Ферменты — высокоэффективные катализаторы. Они повышают скорость катализируемой реакции в 1012 раз и более.
- 38. Неферментативный катализ Вещества A и В в растворе окружены оболочкой из молекул воды (гидратной оболочкой) и
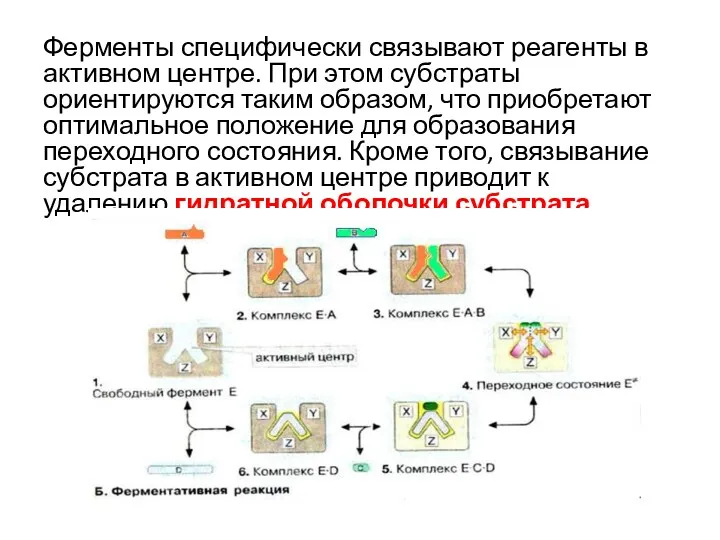
- 39. Ферменты специфически связывают реагенты в активном центре. При этом субстраты ориентируются таким образом, что приобретают оптимальное
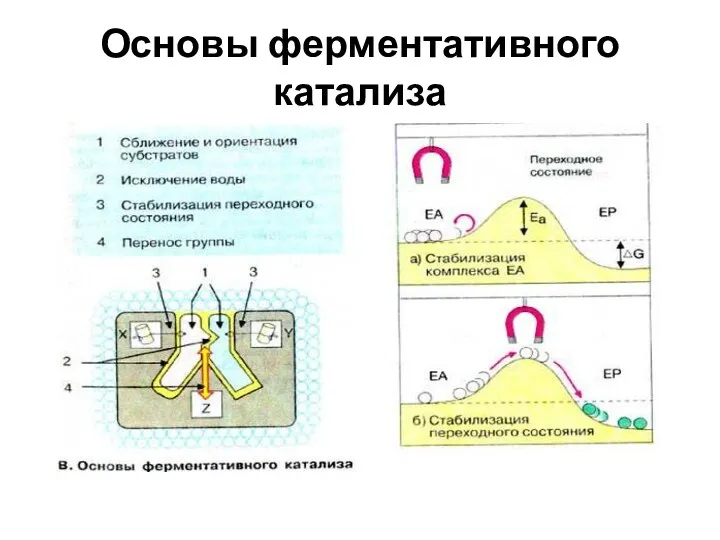
- 40. Основы ферментативного катализа
- 41. 1. Присоединение субстрата (S)к ферменту (Е) с образованием фермент –субстратного комплекса ЕS. 2. Преобразование фермент –
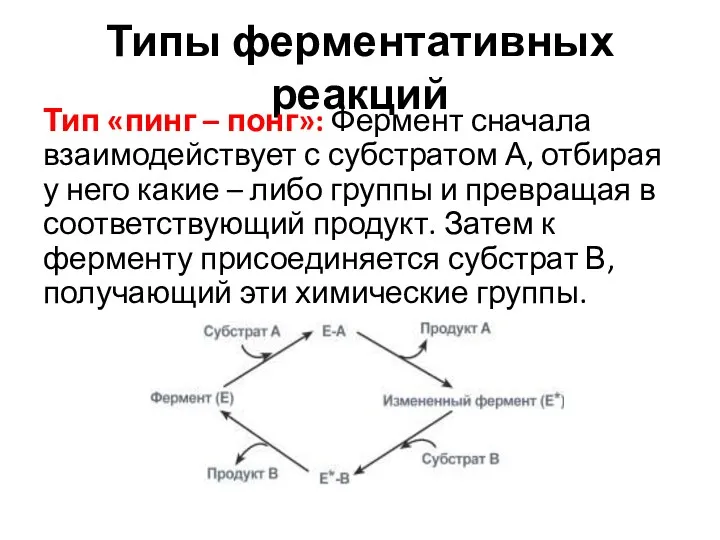
- 42. Типы ферментативных реакций Тип «пинг – понг»: Фермент сначала взаимодействует с субстратом А, отбирая у него
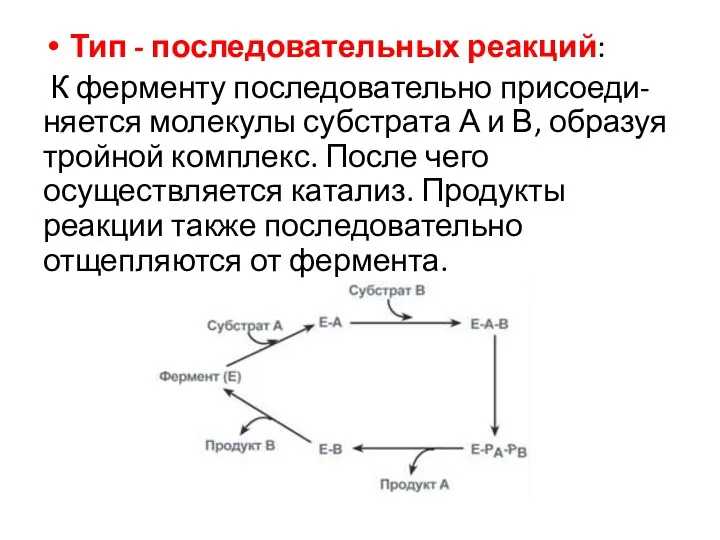
- 43. Тип - последовательных реакций: К ферменту последовательно присоеди-няется молекулы субстрата А и В, образуя тройной комплекс.
- 44. Механизмы катализа Кислотно – основной катализ - в активном центре фермента находятся группы специфических аминокислотных остатков,
- 47. Механизм Л.Михаэлиса и М.Ментена Механизм простейшей кислотно – основной (КО) ферментативной реакции: E ≡ enzyme k1
- 48. Вывод уравнения Для нахождения концентрации CES применим МКСК: WES = r1 - r-1 - r2 =
- 49. Вывод уравнения Текущая концентрация CE по уравнению МБ CE = CE0 - CES ; CES =
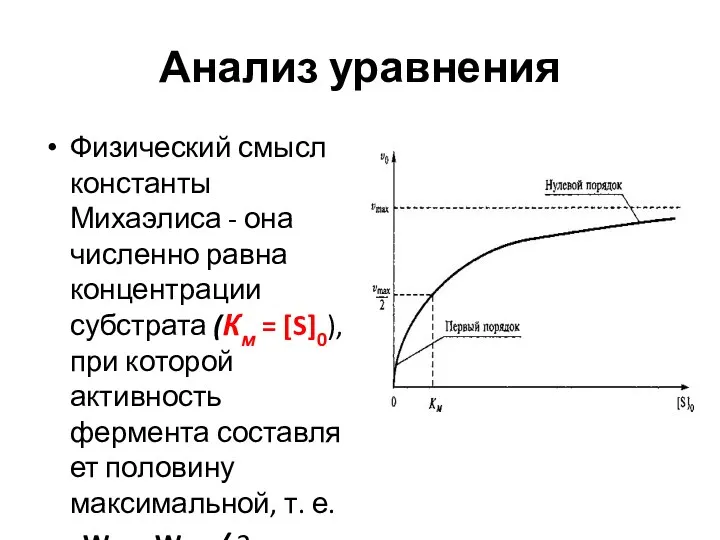
- 50. Анализ уравнения Wp = k2 CS0CE0/(KМ + CS0) Обозначим : Wmax = k2CE0 – это максимальная
- 51. Анализ уравнения Физический смысл константы Михаэлиса - она численно равна концентрации субстрата (Км = [S]0), при
- 52. Продолжение необходимого материала для экзамена
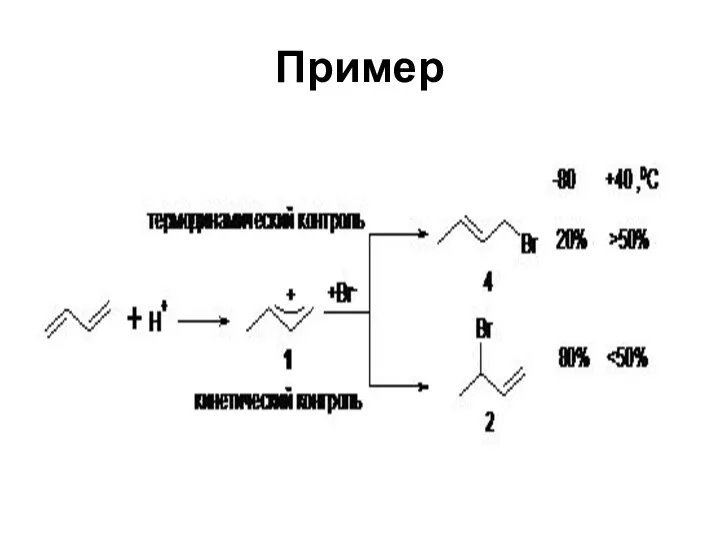
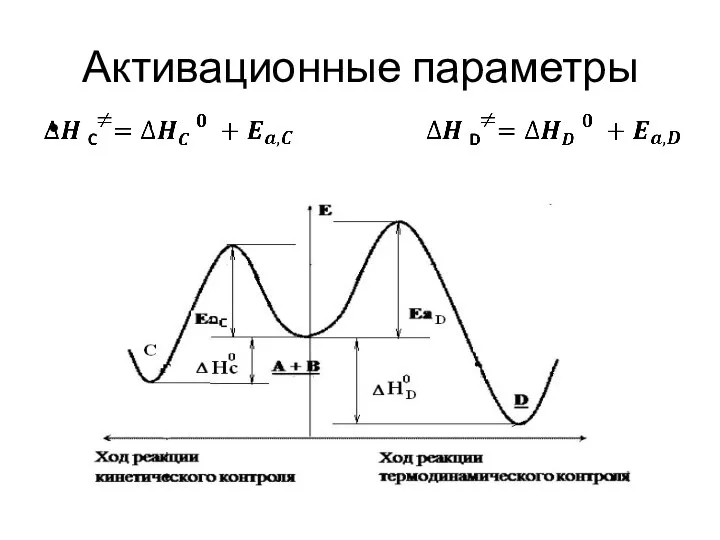
- 53. Кинетический и термодинамический контроль реакции А +В ? С + D Реагенты А +В образуют два
- 54. Температурный режим О кинетическом контроле прохождения химической реакции говорят когда из двух или более возможных продуктов
- 55. Пример
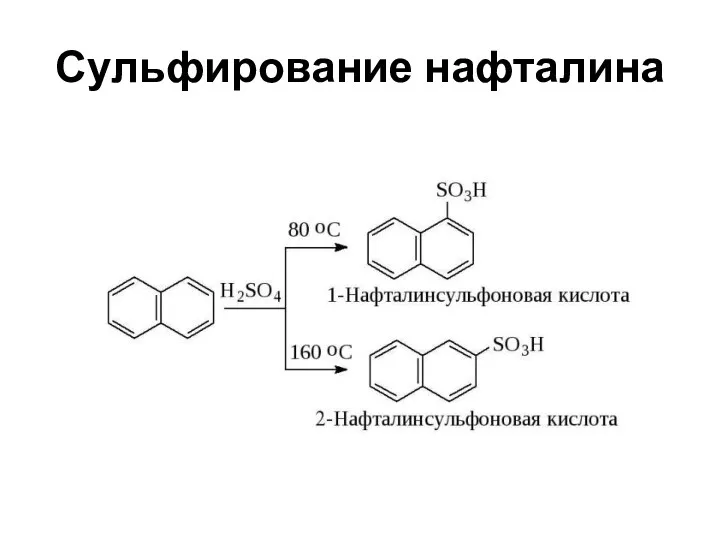
- 56. Сульфирование нафталина
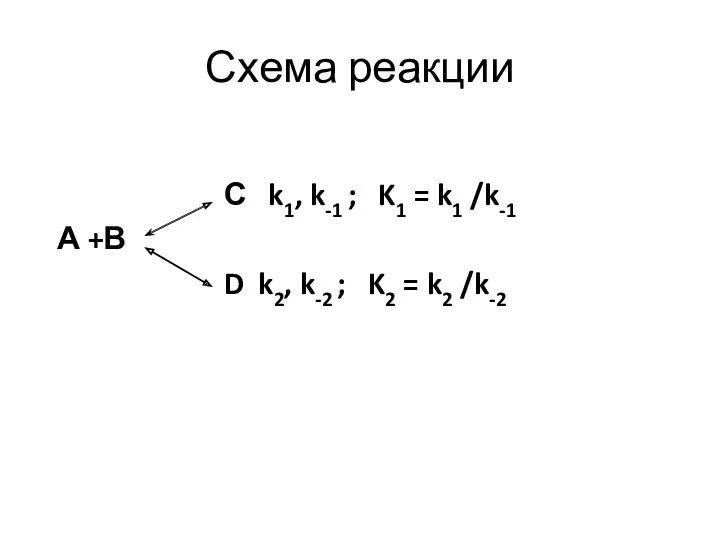
- 57. Схема реакции С k1, k-1 ; K1 = k1 /k-1 А +В D k2, k-2 ;
- 58. Активационные параметры
- 60. Скачать презентацию








































 Водород. Сущность водорода как химического элемента
Водород. Сущность водорода как химического элемента Этиловый спирт в жизни человека
Этиловый спирт в жизни человека Целлюлоза
Целлюлоза Введение в органическую химию
Введение в органическую химию 20230419_azot
20230419_azot Иондық байланыс
Иондық байланыс Поверхностные явления
Поверхностные явления Основания
Основания Камни и Лев
Камни и Лев Ароматические соединения. Тема № 5
Ароматические соединения. Тема № 5 Реакции ионного обмена. Теория химического строения органических соединений. 9 класс
Реакции ионного обмена. Теория химического строения органических соединений. 9 класс Валентность и степень окисления 8 класс
Валентность и степень окисления 8 класс Менделеевские уроки. День науки
Менделеевские уроки. День науки Гидролиз неорганических веществ - солей. (11 класс)
Гидролиз неорганических веществ - солей. (11 класс) Электролиз. 11 класс
Электролиз. 11 класс Ртуть. Использование ртути
Ртуть. Использование ртути Неоднородные системы, их классификация, методы разделения. Лекция 4
Неоднородные системы, их классификация, методы разделения. Лекция 4 Влияние скорости охлаждения на структуру и свойства сталей
Влияние скорости охлаждения на структуру и свойства сталей Спирти. Феноли. Етери
Спирти. Феноли. Етери Полимеры, их классификации и способы получения
Полимеры, их классификации и способы получения Строение и физические свойства металлов
Строение и физические свойства металлов 5511c750430548bfa1da4ba840324bb2
5511c750430548bfa1da4ba840324bb2 Альдегиды и кетоны
Альдегиды и кетоны Амфотерные органические и неорганические соединения
Амфотерные органические и неорганические соединения Гидролиз органических и неорганических соединений
Гидролиз органических и неорганических соединений Современная химия. (Лекция 6)
Современная химия. (Лекция 6) Study of the properties of halogens and the determination of halide ions in aqueous solution
Study of the properties of halogens and the determination of halide ions in aqueous solution Водно-солевой режим оборотной системы. Эффективность использования воды. Коэффициент концентрирования солей
Водно-солевой режим оборотной системы. Эффективность использования воды. Коэффициент концентрирования солей